
【题目】已知某市售“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”中NaClO的物质的量浓度约为__mol/L。(保留1位小数)
(2)该同学参阅此“84消毒液”的配方,欲用NaClO固体配制480mL与市售物质的量浓度相同的“84消毒液”,下列说法正确的是___(填序号)。
A.如图所示的仪器中有三种是不需要的
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒会导致结果偏低
D.需要称量NaClO固体的质量为143.0g

(3)“84消毒液”与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用98%(密度为1.84g/cm3)的浓硫酸配制500mL2.3mol/L的稀硫酸用于增强“84消毒液”的消毒能力。
①需用浓硫酸的体积为___mL。
②取用任意体积的浓硫酸时,下列物理量中不随所取体积的多少而变化的是____。
A.溶液中H2SO4的物质的量 B.溶液的浓度 C.溶液的质量 D.溶液的密度
③配制该稀硫酸过程中,下列情况会使所配制的溶液的浓度大于2.3mol/L的有___。
A.未经冷却趁热将溶液注入容量瓶中并进行定容
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视容量瓶刻度线
【答案】4.0 C 62.5 BD AD
【解析】
(1)根据c(NaClO)=![]() 计算溶液的物质的量浓度;
计算溶液的物质的量浓度;
(3)①根据c=![]() 计算浓硫酸物质的量浓度,根据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸体积;
计算浓硫酸物质的量浓度,根据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸体积;
③分析操作对溶质的物质的量和溶液体积的影响,根据c=![]() 进行误差分析。
进行误差分析。
(1)c(NaClO)=![]() =
=![]() =4.0 molL-1,故答案为:4.0。
=4.0 molL-1,故答案为:4.0。
(2)A.用NaClO固体配制480mL含NaClO质量分数为25%的消毒液,需要用到天平、烧杯、500mL容量瓶、玻璃棒、胶头滴管,不用图中圆底烧瓶和分液漏斗,共2种仪器,故A错误;
B.容量瓶用蒸馏水洗净后,不需要烘干就能用于溶液配制,故B错误;
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,造成溶质损失,配制的溶液浓度偏低,故C正确;
D.因为没有480mL的容量瓶,需要配制500mL溶液,需要NaClO的质量为:m=0.5L×4.0mol/L×74.5g/mol=149g,故D错误。
故答案为:C。
(3)①浓硫酸物质的量浓度c=![]() =18.4mol/L,设需要浓硫酸体积为V,则根据溶液稀释过程中溶质的物质的量不变,得:V×18.4mol/L=500×2.3mol/L,计算得出V=62.5mL,故答案为:62.5。
=18.4mol/L,设需要浓硫酸体积为V,则根据溶液稀释过程中溶质的物质的量不变,得:V×18.4mol/L=500×2.3mol/L,计算得出V=62.5mL,故答案为:62.5。
②A.溶液中硫酸的物质的量n=cV,所以与溶液的体积有关,故A不选;
B.溶液具有均一性,浓度与溶液的体积无关,故B选;
C.溶质的质量与溶质的物质的量有关,根据A可以知道溶质的质量与溶液体积有关,故C不选;
D.溶液的密度为溶液的性质,与溶液的体积无关,故D选。
故答案为:BD。
③A.未经冷却趁热将溶液注入容量瓶中,冷却后溶液体积偏小,溶液浓度偏高,故A选;
B.摇匀后发现液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故B不选;
C.容量瓶中原有少量蒸馏水,对溶液体积和溶质的物质的量都不会产生影响,溶液浓度不变,故C不选;
D.定容时俯视观察液面,导致溶液体积偏小,溶液浓度偏高,故D选。
故答案为:AD。


科目:高中化学 来源: 题型:
【题目】在25mL0.1mol·L-1某一元碱中,逐滴加入0.1mol·L-1醋酸,滴定曲线如图所示。则下列说法不正确的是

A. 该碱溶液可以溶解Al(OH)3
B. a点对应的体积值大于25mL
C. C点时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. D点时,c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某0.2L无土栽培用的营养液中含有KCl、K2SO4、NH4Cl三种溶质,测得该营养液中部分离子的浓度柱状图如图甲所示:

(1)该营养液中K2SO4的物质的量浓度为____mol·L-1,含KCl的质量为____。
(2)该营养液中NH4Cl的物质的量为____。
(3)将该营养液加水稀释,稀释过程中NH![]() 的浓度(c)随溶液体积(V)变化的曲线如图乙所示,则V1=____,V2=___。
的浓度(c)随溶液体积(V)变化的曲线如图乙所示,则V1=____,V2=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)

④CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴。
请回答:
(1)写出浸出过程中Co2O3发生反应的离子方程式___________。
(2)向浸出液中加入 NaClO3发生主要反应的离子方程式___________。
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀Ⅹ成分为___________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示,萃取剂使用的适宜pH范围是___________。(填选项序号字母)

A 1.0~2.0 B 2.5~3.5 C 4.0~5.0
(5)制得的CoCl2·6H2O在烘干时需减压烘干的原因是___________。
(6)为测定粗产品中CoCl2·6H2O含量,称取2g的粗产品溶于水,配成100mL溶液,取出20mL置于锥形瓶,加入K2CrO4做指示剂( Ag2CrO4为砖红色沉淀),用0.2mol/L的AgNO3溶液滴定至终点,重复2-3次,平均消耗AgNO3标准溶液10.00mL。该粗产品中CoCl2·6H2O的质量分数为___________。用K2CrO4做指示剂时,需要控制溶液pH值为6.5~10.5,试分析原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性,下列有关说法正确的是
A. H3PO2溶于水的电离方程式为:H3PO2 ![]() 3H++PO23-
3H++PO23-
B. H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C. 将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的氧化产物为H3PO4
D. 用惰性电极电解NaH2PO2溶液,其阳极反应式为:H2PO2--4e-+2H2O=O2+6H++PO23-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O) > c(NH4+)> c(Cl-)> c(OH-)
C.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
D.0.1 mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:![]() c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度下,在2L的密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g) ![]() cC(g) △H = —QkJ·mol—1(Q>0)。12s时达到平衡,生成C的物质的量为0.8mol,反应进程如下图所示。
cC(g) △H = —QkJ·mol—1(Q>0)。12s时达到平衡,生成C的物质的量为0.8mol,反应进程如下图所示。
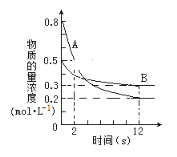
(1)化学计量数b:c=_______
(2)前12s内,A的平均反应速率为________________
(3)12s内,A和B反应放出的热量为__________
Ⅱ.已知:Cu+2FeCl3=2FeCl2+CuCl2利用这一反应,试设计一个原电池,指出电极材料名称,并写出电极反应式
正极:__________ 电极反应:__________________
负极:__________ 电极反应:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象及所得出的结论或解释均正确的是
选项 | 实验操作 | 现象 | 结论或解释 |
① | 用玻璃棒蘸取次氯酸钠溶液,点在 | 试纸最终显蓝色 | 次氯酸钠溶液显碱性 |
② | 向废 | 未出现红色固体 | X中一定不含 |
③ | 将 | 白色沉淀变为蓝色沉淀未出现红色固体 |
|
④ | 用 | 迅速产生无色气体 | 形成锌铜原电池加快制取氢气的速率 |
A. ①B. ②C. ③D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铁是聚合反应中常用的一种催化剂,易潮解变质,800℃以上可升华,高温时FeBr3会快速分解为FeBr2。某化学小组同学用下图所示装置制备溴化亚铁,请回答相关问题:
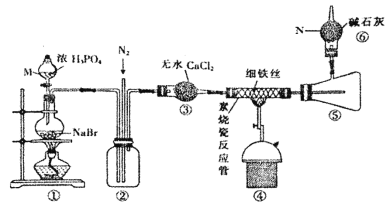
(1)仪器M、N的名称依次是________、________。
(2)装置⑥的作用是____________,从装置末端排出的气体是否需要处理________(填“是”或“否”)
(3)实验结束时要关闭热源并继续通入N2一段时间,此时通N2的目的是__________。
(4)将浓磷酸换成浓硫酸同样能制得HBr,但反应过程中圆底烧瓶内的溶液变为橙黄色。
①浓磷酸和浓硫酸均能用于制HBr的原因是硫酸和磷酸都具备某种性质,该性质是________。
②溶液变橙黄色是因为发生了副反应___________(写化学方程式)。
③浓磷酸换成浓硫酸对产品纯度_____ (填“有”或“没有”)影响,理由是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com