
【题目】
(1)下列描述正确的是 (填写序号)
A.浓硝酸和液溴均保存在棕色试剂瓶中,其目的是防止挥发 |
B.容量瓶、分液漏斗在使用时需要检验是否漏水 |
C.海带提碘实验中,灼烧海带时需要用到的仪器有玻璃棒、蒸以皿、泥三角、三脚架、酒精灯 |
D.向含有Fe2+的FeCl3溶液中通入Cl2或滴加H2O2均可除去Fe2+ |
E.检验Na2SO3固体是否被氧化:
试样![]() 沉淀不溶解
沉淀不溶解
(2)某兴超小组采用如图所示装置制取SO2,并制备硫代硫酸钠(Na2S2O3),反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2已知硫代硫酸钠受热、遇酸易分解,回答下列问题:
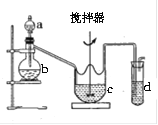
①b中反应的离子方程式为 ,c中试剂为 。
②反应开始后,c中先有浑浊产生,后又变澄清,此浑浊物是 (写物质名称)
③d中的试剂为 。
④为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是 。
【答案】(1)BD
(2)①![]()
![]() 的混合液 ②硫③NaOH溶液
的混合液 ②硫③NaOH溶液
④若SO2过量,溶液显酸性,产物分解:![]()
【解析】试题分析:(1)浓硝酸见光易分解,所以保存在棕色试剂瓶中,故A错误;B.容量瓶、分液漏斗在使用时需要检验是否漏水,故B正确;灼烧固体时需要用到的仪器有玻璃棒、坩埚、泥三角、三脚架、酒精灯,故C错误;Cl2或H2O2均可把Fe2+氧化为Fe3+,故D正确。(2)①b中用亚硫酸钠和硫酸反应制取SO2, 离子方程式为![]() ;根据反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,c中试剂为
;根据反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,c中试剂为![]() 的混合液;②反应开始后,c中先有浑浊产生,方程式为
的混合液;②反应开始后,c中先有浑浊产生,方程式为![]() ,浑浊物是硫;③为吸收二氧化硫,d中的试剂为氢氧化钠溶液;④若SO2过量,溶液显酸性,产物分解:
,浑浊物是硫;③为吸收二氧化硫,d中的试剂为氢氧化钠溶液;④若SO2过量,溶液显酸性,产物分解:![]() ,为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量。
,为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)下列物质中,属于弱电解质的是(填序号,下同) ,属于非电解质是 。
①硫酸氢钠固体 ②次氯酸钠 ③氯化氢气体 ④蔗糖 ⑤硫酸钡 ⑥氨气 ⑦冰醋酸
(2)写出下列物质在水中的电离方程式:碳酸: 。次氯酸钠: 。
(3)甲、乙两瓶氨水的浓度分别为1 molL-1、0.1 molL-1,则c(OH﹣)甲:c(OH﹣)乙 10(填“大于”、“等于”或“小于”)。
(4)现有常温条件下甲、乙、丙三种溶液,甲为0.1 molL-1的NaOH溶液,乙为0.1 molL-1的HCl溶液,丙为0.1 molL-1的CH3COOH溶液,甲、乙、丙三种溶液中由水电离出的c(OH﹣)的大小关系为 。
(5)NO2与NO之间存在如下可逆反应:2NO2![]() 2NO+O2。T oC时,在一恒容密闭容器中充入适量NO2,反应达到平衡状态的标志是 。(填序号)
2NO+O2。T oC时,在一恒容密闭容器中充入适量NO2,反应达到平衡状态的标志是 。(填序号)
①混合气体的颜色不再改变的状态
②混合气体的密度不再改变的状态
③混合气体的压强不再改变的状态
④混合气体的平均相对分子质量不再改变的状态
⑤![]() 的比值不再改变的状态
的比值不再改变的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)准确称取烧碱样品5.0g,将样品配成250mL的待测液。
(2)取10.00mL待测液,用 量取注入锥形瓶中。(填仪器)
(3)用0.2000mol/L标准盐酸溶液滴定待测烧碱溶液, 滴定时左手旋转 的玻璃活塞,右手不停地摇动 ,两眼注视 ,直到滴定终点。
(4)根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度: 。
滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 4.20 | 25.70 |
(5)根据上述测定数据,分析得到合理数据,计算烧碱的纯度 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究利用催化技术将汽车尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO(g)+2CO (g)![]() 2CO2(g)+N2(g) △H.
2CO2(g)+N2(g) △H.
为了测定在某种催化剂作用下的反应速度,某温度下,在容积固体的容器内进行此反应,并用气体传感器测得不同时间的NO和CO浓度如表:
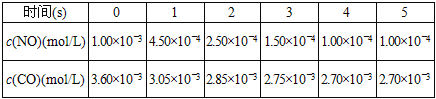
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在该反应的平衡常数的表达式K=________________。
(2)该反应在此温度下能够自发进行,说明△H___________0(填写“>”、“<”、“=”)。
若只将反应条件改为绝热,平衡时NO的浓度将___________(填“增大”、“减小”、“不变”)
(3)前2s内的平均反应速率v(N2)__________________.
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
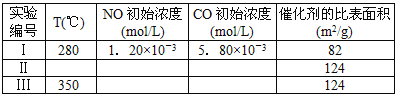
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,参考实验I实验条件下混合气体中NO浓度随时间变化的趋势曲线图,画出II、III条曲线图,并标明各条曲线的实验编号。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A. 加热 B. 不用稀硫酸,改用98%浓硫酸
C. 滴加少量CuSO4溶液 D. 不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.lmolNaCl 固体中含有NA个Na+
B.18gD2O和18gH2 O中含有的质子数均为10NA
C.标准状况下2.24LH2O 含有的共价键数为0.2NA
D.密闭容器中2molNO 与lmolO2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是二十一世纪的“明星金属”。工业制钛以金红石为原料,发生的反应是:

关于反应I、Ⅱ的下列说法中正确的是
A. 反应I中的TiO2是氧化剂
B. TiCl4在反应I中是还原产物,在反应Ⅱ中是氧化剂
C. a=b=c=2
D. 每生成9.6 g Ti,反应I、Ⅱ中共转移0.8 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量的铜溶于一定量浓HNO3中,产生NO、N2O4 NO2的混合气体,这些气体若与1.12 LO2(标准状况)混合后通入水中,气体被水完全吸收。若向原所得溶液中加入5mol.L的H2SO4溶液100mL,则继续溶解的铜的质量
A.6.4g B.9.6g C.19.2g D.24g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑,下列说法错误的是
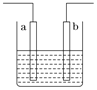
A. a、b不可能是同种材料的电极
B. 该装置可能是电解池,电解质溶液为稀盐酸
C. 该装置可能是原电池,电解质溶液为稀盐酸
D. 该装置可看作是铜-锌原电池,电解质溶液是稀硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com