
【题目】下表是元素周期表短周期的一部分:
① | ||||||||
⑨ | ② | ③ | ④ | |||||
⑤ | ⑥ | ⑦ | ⑧ | |||||
(1) ①-⑦元素中非金属性最强的元素位于周期表中的位置为______________________。
(2) ③与⑤形成的化合物与水反应产生气体,该反应的化学方程式 _______________ 。该化合物的电子式为______
(3) ④所形成的单质与水反应的方程式 _____________。
(4) ②、③、⑨的最高价含氧酸的酸性由弱到强的顺序是__________________(用化学式表示)。
(5) 表中元素⑤和⑥的最高价氧化物的水化物之间相互反应的离子方程式为____________。
(6) ②的气态氢化物的实验室制法的反应原理:____________________;(写出化学方程式)
②的气态氢化物和它的最高价氧化物的水化物反应的产物为______________(“离子”或“共价”)化合物。
【答案】第二周期VIIA族 略 略 2F2+2H2O=4HF+O2↑ H2SiO3< H2CO3< HNO3 Al(OH)3+OH-== AlO2- + 2H2O 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 离子
CaCl2+2NH3↑+2H2O 离子
【解析】
由元素在周期表中位置,可知①为H、②为C、③为N、④为F、⑤为Na、⑥为Al、⑦为Si、⑧为S,则
(1)同周期自左而右非金属性增强,同主族自上而下非金属性减弱;
(2)③与⑤形成的化合物为Na3N,依据氮化钠是离子化合物,三个钠原子失去三个电子,给N原子,使N原子最外层达到稳定结构,电子式需要标注离子所带电荷数;
(3)④所形成的单质为氟气,与水反应是生成HF与氧气;
(4)非金属性越强,对应元素最高价含氧酸的酸性越强;
(5)表中元素⑤和⑥对应最高价氧化物的水化物分别为NaOH与Al(OH)3;
(6)②的气态氢化物为氨气,实验室用氯化铵与氢氧化钙在加热条件下制得,铵盐属于离子化合物。
由元素在周期表中位置,可知①为H、②为C、③为N、④为F、⑤为Mg、⑥为Al、⑦为Si、⑧为S,则
(1)①-⑦元素中非金属性最强的元素为F,原子序数为9,则在元素周期表的位置为;第二周期VIIA族,
故答案为:第二周期VIIA族;
(2)③与⑤形成的化合物为Na3N,Na3N中Na是+1价,N是-3价,方程式是Na3N+3H2O=3NaOH+NH3↑,其电子式为:![]() ,
,
故答案为:Na3N;![]() ;
;
(3)④所形成的单质为氟气,与水反应是生成HF与氧气,其反应方程式为:2F2+2H2O=4HF+O2↑,
故答案为:2F2+2H2O=4HF+O2↑;
(4)②、③、⑨的最高价含氧酸分别为H2CO3、HNO3、H2SiO3,因非金属性强弱顺序为: Si< C< N,则②、③、⑨的最高价含氧酸的酸性由弱到强的顺序是;H2SiO3< H2CO3< HNO3,
故答案为:H2SiO3< H2CO3< HNO3;
(5)表中元素⑤和⑥的最高价氧化物的水化物分别为NaOH与Al(OH)3,两者反应生成偏铝酸钠与水,其对应的离子方程式为:Al(OH)3+OH-== AlO2- + 2H2O,
故答案为:Al(OH)3+OH-== AlO2- + 2H2O;
(6)②的气态氢化物为氨气,实验室用氯化铵与氢氧化钙在加热条件下制得,反应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;②的气态氢化物氨气和它的最高价氧化物的水化物硝酸发生反应生成硝酸铵,该化合物属于离子化合物,
CaCl2+2NH3↑+2H2O;②的气态氢化物氨气和它的最高价氧化物的水化物硝酸发生反应生成硝酸铵,该化合物属于离子化合物,
故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;离子;
CaCl2+2NH3↑+2H2O;离子;


科目:高中化学 来源: 题型:
【题目】如表为周期表中短周期的一部分,若X原子的最外层电子数是Y原子内层电子总数的![]() ,则下列说法不正确的是
,则下列说法不正确的是![]()
![]()
W |
|
|
|
| X | Y | Z |
A. Y的最高价氧化物的水化物的酸性比X的强 B. W、Z组成的某化合物是一种常见的溶剂
C. 原子半径大小比较:![]() D. W形成的氢化物种类很多
D. W形成的氢化物种类很多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置用于实验室制氨气或验证氨气的某化学性质,其中能达到实验目的的是
A.  制取氨气B.
制取氨气B.  除去氨气中的水蒸气
除去氨气中的水蒸气
C.  验证氨气具有还原性D.
验证氨气具有还原性D.  吸收尾气
吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述,正确的是( )
A. 加浓溴水,然后过滤,可除去苯中混有的少量乙烯
B. 苯、溴水和铁粉混合可制成溴苯
C. 氨基酸属于高分子化合物
D. 已知甲苯苯环上的二氯取代物有6种,则甲苯苯环上的三氯取代物也有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子因发生水解反应而不能大量共存的是
A. Ba2+、Cl-、Na+、SO42- B. Al3+、K+、HCO3-、Cl-
C. H+、Fe2+、NO3-、SO42- D. H+、Na+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知由短周期元素构成的三种粒子:甲a(单核带一个单位正电荷)、乙I(四核不带电荷)、丙e(双核带一个单位负电荷),它们都有10个电子。物质A由甲、丙构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
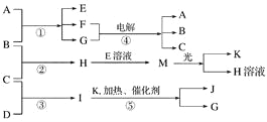
请填写下列空白:
(1)写出下列物质的化学式:B________,I________,J________。
(2) A的化学式是__________________。
(3)写出下列反应的离子方程式:
①H+E(溶液)→M_________________________________________________________。
②I溶于G________________________________________________________________。
(4)写出反应①的化学方程式_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图是等质量的碳酸钠、碳酸氢钠粉末分别与足量的盐酸发生反应时的情景,产生二氧化碳气体的体积较多的试管中加入的固体试剂是________,当反应结束时,A、B中消耗的盐酸的质量之比为________。

(2)实验过程中我们还能感受到碳酸钠与盐酸反应时是放热反应,而碳酸氢钠与盐酸反应时表现为吸热。在A、B试管的反应过程中,反应体系的能量变化的总趋势分别对应于A为________,B为________(填“a”或“b”)。
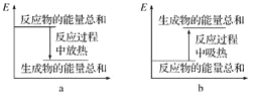
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C
2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C![]() TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg
TiCl4+2CO。将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg![]() Ti+2MgCl2,MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
Ti+2MgCl2,MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
(1)基态钛原子的价电子排布式为_______________________________。
(2)与CO互为等电子体的离子为_____(填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp杂化的分子有__________ 。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于______(填“原子”、“分子”或“离子”)晶体。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是_____________;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 __________。
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如右图所示,则其中Ti4+的配位数为__________。
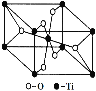
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com