
下列各组比较中,正确的是
| A.原子半径K< Na | B.酸性H2CO3< H2SO4 |
| C.稳定性HF< HCI | D.碱性NaOH< Mg(OH)2 |
B
解析试题分析:同主族自上而下,原子半径逐渐增大,非金属性逐渐减弱,氢化物的稳定性逐渐减弱,A不正确,原子半径K>Na,C不正确,稳定性HF>HCI;非金属性越强,最高价氧化物的水化物的酸性越强,则酸性H2CO3<H2SO4,B正确;同周期自左向右金属性逐渐减弱,最高价氧化物的水化物的碱性逐渐减弱,D不正确,碱性NaOH>Mg(OH)2,答案选B。
考点:考查元素周期律的应用
点评:该题主要是考查学生对元素周期律的熟悉了解程度,以及灵活运用元素周期律解决实际问题的能力。难度不大。该题的关键是熟练记住元素周期律的具体内容,然后结合题意灵活运用即可,有利于培养学生的逻辑思维能力。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:单选题
下图为元素周期表中短周期的一部分,下列说法正确的是
| ① | ② | ③ |
| ④ | ⑤ | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
| A.R的单质能与W的氢化物反应,可证明非金属性:R>W |
| B.最高正价氧化物对应的水化物的酸性:R<W |
| C.X与Z组成的化合物是共价化合物,且又具有两性 |
| D.离子半径:Z>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列不能说明氯的非金属性比硫强的事实是 ( )
①HCl比H2S稳定 ②HCl和H2S的水溶液前者的的酸性强
③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
| A.①②④ | B.① ②⑥ | C.②⑤ | D.①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.第ⅠA族金属单质的密度、熔沸点均随着核电荷数的增大而递增 |
| B.金属锂在氧气中燃烧生成Li2O2 |
| C.金属的还原性:Li>Na>K>Rb |
| D.氢化物的稳定性: HF > HCl > HBr > HI |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
元素X、Y的原子在化学反应中都易失去电子而形成与Ne相同的电子层结构,已
知X的原子序数比Y的原子序数大,下列说法中正确的是
| A.X的金属性比Y的金属性强 |
| B.常温下,X和Y都不能从水中置换出氢 |
| C.X元素的最高化合价比Y元素的最高化合价低 |
| D.Y元素的氢氧化物碱性比X元素的氢氧化物碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60、N5+、等已被发现。下列有关说法中,正确的是( )
| A.H2与H3属于同素异形体 | B.O2与O4属于同位素 |
| C.C60的质量数为720g/mol | D.N5+离子中含有36个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
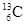 -NMR(核磁共振)可以用于含碳化合物的结构分析。
-NMR(核磁共振)可以用于含碳化合物的结构分析。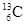 表示的碳原子
表示的碳原子
| A.核外有13个电子,其中4个能参与成键 |
| B.核内有6个质子,核外有7个电子 |
| C.质量数为13,原子序数为6,核内有7个质子 |
| D.质量数为13,原子序数为6,核内有7个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组中化合物的性质比较,不正确的是
| A.酸性:HClO4>HBrO4>HIO4 |
| B.稳定性:PH3>H2S>HCl |
| C.碱性:NaOH>Mg(OH)2>Al(OH)3 |
| D.非金属性:F>O>S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com