
【题目】下列说法错误的是( )
A. 乙醇和乙酸都是常用调味品的主要成分
B. 乙醇和乙酸的沸点和熔点都比C2H6和C2H4的沸点和熔点高
C. 乙酸和乙醇之间能发生酯化反应
D. 乙醇 和乙酸都能发生消去反应
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】(1)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为________、蒸发、结晶、________。
(2)除去KCl溶液中的SO![]() ,依次加入的溶液为(填溶质的化学式): ________________________。
,依次加入的溶液为(填溶质的化学式): ________________________。
(3)下列物质的分离和提纯方法操作为
①油水混合物________;
②自来水制备蒸馏水________;
③碘水中的I2________;
④KNO3溶液得到KNO3________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Ksp[(CH3)2NH)]=l.6×10-4)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定二甲胺溶液的曲线
B. a点溶液中:c[(CH3)2NH2+]>c[CH3]2NH·H2O]
C. d点溶液中:c(H+)=c(OH-)+c[CH3]2NH·H2O]
D. b、c、e三点的溶液中,水的电离程度最大的是b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,有机化合物A只由碳、氢两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平。A、B、C、D、E有如下关系:

则下列推断不正确的是 ( )
A. 鉴别A和甲烷可选择使用酸性高锰酸钾溶液
B. B中含有的官能团为羟基,B物质可以做燃料和造酒原料,也可以用来杀菌消毒
C. 物质C的结构简式为CH3CHO,E的名称为乙酸乙酯
D. B+D→E的化学方程式为:CH3CH2OH+CH3COOH→CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,根据有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/cm3
质量分数:36.5%
(1)该浓盐酸中HCl的物质的量浓度为_______mol/L.
(2)取用任意体积的该盐酸溶液时,下列物理量不随所取体积多少而变化的_________.
A、溶液中H+的物质的量浓度B、溶液中HCl的质量
C、溶液中H+的数目D、溶液的密度
(3)若现有1L 1mol/L的稀盐酸,欲使其浓度增大1倍,采取的措施最合理的是____________.
A、通入标况下HCl气体22.4L
B、将溶液加热浓缩至0.5L
C、往原溶液加入5mol/L盐酸0.6L,再稀释至2L
D、往原溶液加入1L 3mol/L盐酸混合均匀.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(化学式:POCl3)无色透明的带刺激性臭味的液体,熔点1.25℃、沸点1.5℃,在潮湿空气中剧烈发烟,易与水反应。常用作半导体掺杂剂及光导纤维原料。工业上,“氯化水解法”生产三氯氧磷的方法一般是将三氯化磷加入反应釜中,通入氯气,同时滴加水,控制氯水比在3.94左右,并控制氯气和水的通入速率,其流程如下:

(1)在反应釜中将原料加热至105~109℃,“氯化水解法”生产三氯氧磷的化学方程式为___________。
(2)冷凝得到的粗三氯氧磷—般含有PCl3、H3PO3、PCl5和_________(填化学式)等杂质,进一步精制的方法是____________。
(3)已知H3PO3是—种易溶于水的二元弱酸。
①若将20 mL溶液与60 mL NaOH溶液等浓度混合并充分反应,化学方程式为______________。
②往废水中加入适量漂白粉并调节pH呈酸性,可将磷元素转化为磷酸钙沉淀回收,写出将H3PO3转化为磷酸钙的离子方程式:_____________________。
③经上述方法处理后的废水中c(PO43-) = 4×l0-7mol·L-1,溶液中c(Ca2+) =________mol·L-1。
(已知 Ksp[Ca3(PO4)2] = 2×10-29)
(4)工业上,还可以以三氯化磷为原料通过“氧气直接氧化法”制备三氯氧磷。从原理上看,与“氯化水解法”相比,该方法的优点是_______________________。(写出两点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0mol·L-1 的NaOH溶液 240mL
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移⑥洗涤 ⑦定容 ⑧冷却
本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有_________.
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为__________g,要完成本实验该同学应称出__________gNaOH.
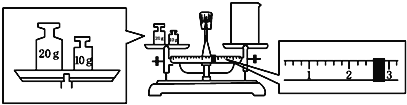
(3)使用容量瓶前必须进行的一步操作是_________________________________.
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________________.
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
A.16. 9 g过氯化钡(BaO2)固体中阴、阳离子总数约为0. 2NA
B.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA
C.a g某气体含分子数为b,c g该气体在标况下的体积为22. 4bc/ aNAL
D.某密闭容器盛有0. l molN2和0. 3 mol H2,在一定条件下充分反应,转移电子的数目为0. 6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com