
【题目】浓硫酸与下列物质作用时,只表现强氧化性的是( )
A. 红热木炭 B. 木材炭化 C. 蓝色硫酸铜晶体 D. 氧化铜
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X,Y,Z,W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( ) 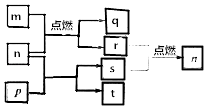
A.Y,Z,W的简单离子的电子层结构相同
B.原子半径:r(X)<r(Y)<r(Z)<r(W)
C.简单氢化物的稳定性:X>Y
D.Y与Z两种元素形成的化合物一定只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的说法正确的是
A.金属原子只有还原性,金属阳离子只有氧化性 B.金属单质在常温下都是固体
C.金属阳离子被还原不一定得到金属单质 D.含金属元素的离子都是阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从含铜废料(如:覆铜板、印刷线路板及铅冰铜等)中提取铜,既可提高资源的利用率又可减少重金属污染.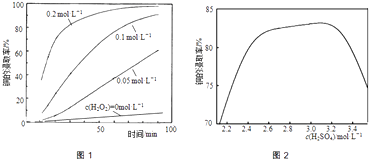
(1)废覆铜板(Cu和Sn组成)可用CuSO4和H2SO4混合溶液作电解质溶液,直接电解回收精铜,阳极上发生的电极反应为 .
(2)废印刷线路板中的铜常用含盐酸的FeCl3溶液或H2O2﹣HCl﹣NaCl混合溶液浸取回收.
①用FeCl3溶液浸取铜时发生反应的离子方程式为;若加盐酸不足,反应一段时间后线路板表面有红褐色沉淀,产生红褐色沉淀的原因是 .
②将粉碎后的废印刷线路板放入三口烧瓶中,分别加入由0.3molL﹣1盐酸、0.5molL﹣1NaCl及不同浓度的H2O2组成的混合溶液,在温度、搅拌速率及固液比等均相同时,铜的浸取率随H2O2的浓度和时间的变化如图1所示.当c(H2O2)=0molL﹣1时,也有少量的铜被浸出,其原因是 .
③用H2O2﹣HCl﹣NaCl混合溶液浸取时,其浸取过程包括:
(Ⅰ) Cu+H2O2+2H+=Cu2++2H2O
(Ⅱ) Cu2++Cu2Cu+
(Ⅲ) Cu++nCl﹣CuCln(n﹣1)﹣
(Ⅳ) 2CuCln(n﹣1)﹣+2H++H2O2=2Cu2++2H2O+2nCl﹣
其他条件相同时,增大下列离子浓度可以加速Cu从废电路板中浸出的是(填序号).
a.Na+ b.Cu2+ c.Cl﹣d.OH﹣
(3)铅冰铜(PbS、Cu2S及FeS的混合物)可用HCl﹣H2O2混合溶液浸取.
①Cu2S被HCl﹣H2O2混合溶液浸取得到硫酸铜和氯化铜溶液的化学方程式为 .
②若由H2SO4代替HCl﹣H2O2中的HCl,其他条件相同,铜的浸取率随硫酸浓度的变化如图2所示.当H2SO4浓度大于3.1molL﹣1时,硫酸浓度越大,铜的浸取率反而越小,其原因可能是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化石墨烯(结构如图1所示)是一种性能优异的新型碳材料.实验室制备氧化石墨烯的一种方法如图2: 
(1)将浓硫酸“冷却至0℃”可采用的方法是 .
(2)步骤②采用100目鳞片状的石墨,其主要目的是;图3示的“搅拌”方式为 .
(3)步骤③④中加NaNO3和KMnO4的作用是 .
(4)步骤⑧H2O2还原剩余的KMnO4反应的离子方程式为;检验洗涤已无SO42﹣的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的熔、沸点高低只与范德华力有关的是( )
A.Li、Na、K、PbB.HF、HCl、HBr、HI
C.LiCl、NaCl、KCl、RbClD.F2、Cl2、Br2、I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用甲烷制乙酸乙酯,欲使其原子利用率达到最高,还需要消耗的其他反应物是( )
A. CO B. CO2和H2O C. H2O和O2 D. CH3OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com