
【题目】从含铜废料(如:覆铜板、印刷线路板及铅冰铜等)中提取铜,既可提高资源的利用率又可减少重金属污染.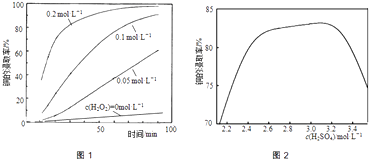
(1)废覆铜板(Cu和Sn组成)可用CuSO4和H2SO4混合溶液作电解质溶液,直接电解回收精铜,阳极上发生的电极反应为 .
(2)废印刷线路板中的铜常用含盐酸的FeCl3溶液或H2O2﹣HCl﹣NaCl混合溶液浸取回收.
①用FeCl3溶液浸取铜时发生反应的离子方程式为;若加盐酸不足,反应一段时间后线路板表面有红褐色沉淀,产生红褐色沉淀的原因是 .
②将粉碎后的废印刷线路板放入三口烧瓶中,分别加入由0.3molL﹣1盐酸、0.5molL﹣1NaCl及不同浓度的H2O2组成的混合溶液,在温度、搅拌速率及固液比等均相同时,铜的浸取率随H2O2的浓度和时间的变化如图1所示.当c(H2O2)=0molL﹣1时,也有少量的铜被浸出,其原因是 .
③用H2O2﹣HCl﹣NaCl混合溶液浸取时,其浸取过程包括:
(Ⅰ) Cu+H2O2+2H+=Cu2++2H2O
(Ⅱ) Cu2++Cu2Cu+
(Ⅲ) Cu++nCl﹣CuCln(n﹣1)﹣
(Ⅳ) 2CuCln(n﹣1)﹣+2H++H2O2=2Cu2++2H2O+2nCl﹣
其他条件相同时,增大下列离子浓度可以加速Cu从废电路板中浸出的是(填序号).
a.Na+ b.Cu2+ c.Cl﹣d.OH﹣
(3)铅冰铜(PbS、Cu2S及FeS的混合物)可用HCl﹣H2O2混合溶液浸取.
①Cu2S被HCl﹣H2O2混合溶液浸取得到硫酸铜和氯化铜溶液的化学方程式为 .
②若由H2SO4代替HCl﹣H2O2中的HCl,其他条件相同,铜的浸取率随硫酸浓度的变化如图2所示.当H2SO4浓度大于3.1molL﹣1时,硫酸浓度越大,铜的浸取率反而越小,其原因可能是 .
【答案】
(1)Cu﹣2e﹣=Cu2+和Sn﹣2e﹣=Sn2+
(2)2Fe3++Cu=2Fe2++Cu2+;c(H+)和c(Fe3+)小,有利于Fe3+水解生成Fe(OH)3沉淀;液面上方空气中O2随搅拌不断进入溶液,溶解的O2将铜氧化而被浸取;bc
(3)Cu2S+5H2O2+2HCl=CuCl2+CuSO4+6H2O;过量的硫酸会生成PbSO4沉淀包裹在铅冰铜颗粒表面,使铜无法与浸出液接触
【解析】解:(1)电解法精炼铜,阳极为活性电极,电极本身参与放电,铜失去电子发生氧化反应,电极反应式:Cu﹣2e﹣=Cu2+;锡失去电子生成锡离子,电极反应式:Sn﹣2e﹣=Sn2+;
所以答案是:Cu﹣2e﹣=Cu2+ 和Sn﹣2e﹣=Sn2+;
2)①三价铁离子能够氧化铜生成铜离子,本身被还原为二价铁离子,离子方程式:2Fe3++Cu=2Fe2++Cu2+;
若加盐酸不足,溶液中氢离子浓度较小,三价铁离子水解生成氢氧化铁,所以若加盐酸不足,反应一段时间后线路板表面有红褐色沉淀;
所以答案是:2Fe3++Cu=2Fe2++Cu2+;
c(H+)和c(Fe3+)小,有利于Fe3+水解生成Fe(OH)3沉淀;
②当c(H2O2)=0molL﹣1时,液面上方空气中O2随搅拌不断进入溶液,溶解的O2将铜氧化而被浸取,所以也有少量的铜被浸出;
所以答案是:液面上方空气中O2随搅拌不断进入溶液,溶解的O2将铜氧化而被浸取;
③a.依据给出的方程式可知,上述反应与钠离子都无关,所以改变钠离子的浓度,不影响Cu从废电路板中浸出,故a不选;
b.由Cu2++Cu2Cu+可知增大铜离子浓度,上述反应的速率加快,故b选;
c.由Cu++nCl﹣CuCln(n﹣1)﹣可知增大Cl﹣浓度,反应Ⅲ加快,故c选;
d.氢氧根离子能够与氢离子、铜离子反应,增大氢氧根离子浓度,能够使氢离子、铜离子浓度减小,反应速率减慢,故d不选;
故选:bc;
3)①Cu2S在盐酸的酸性环境下被过氧化氢生成硫酸铜、氯化铜和水,依据得失电子守恒,原子个数守恒反应的方程式为:Cu2S+5H2O2+2HCl=CuCl2+CuSO4+6H2O;
所以答案是:Cu2S+5H2O2+2HCl=CuCl2+CuSO4+6H2O;
②由H2SO4代替HCl﹣H2O2中的HCl,其他条件相同,铜的浸取率随硫酸浓度的变化如图2所示.当H2SO4浓度大于3.1molL﹣1时,过量的硫酸会生成PbSO4沉淀包裹在铅冰铜颗粒表面,使铜无法与浸出液接触,使得硫酸浓度越大,铜的浸取率反而越小;
所以答案是:过量的硫酸会生成PbSO4沉淀包裹在铅冰铜颗粒表面,使铜无法与浸出液接触;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。当丙池中F极质量增加3.2 g时,回答下列问题。
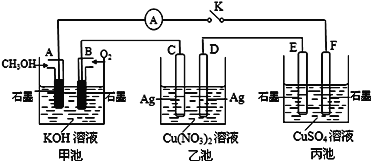
(1)甲、乙分别是什么装置________________、__________________。
(2)写出A电极的电极反应式: _______________________________,丙池总反应的离子方程式__________________________________。
(3)甲池中B电极理论上消耗O2的体积(标准状况下)___________mL。乙池中Cu(NO3)2溶液的浓度____________________(填“变大”、“变小”或“不变”)。
(4)若丙池中溶液的体积为1000 mL,此时丙池中溶液的pH为_________________。
Ⅱ.Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2===4LiCl+S+SO2↑。
(1)电池正极发生的电极反应式为__________________________________________________。
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,反应的化学方程式为______________________________。
(3)组装该电池必须在无水、无氧的条件下进行,原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法正确的是( )
A. Na2O2是碱性氧化物,可以做潜水艇中的供氧药品。
B. Fe2O3俗称铁红,可用于制作红色油漆。
C. 烧碱和小苏打都可用于治疗胃酸过多
D. 氢氧化铁胶体具有吸附性,可用于自来水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质所含的杂质(括号内的物质)所选用的试剂不正确的是( )
A.乙酸(苯甲酸):NaOH溶液
B.甲烷(乙炔):溴水
C.苯(苯甲酸):NaOH溶液
D.乙炔(硫化氢):亚硫酸钠酸性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氢气的燃烧热为△H=﹣285.5kJ?mol﹣1 , 则电解水的热化学方程式为2H2O(l) ![]() 2H2(g)+O2(g)△H=+285.5k?Jmol﹣1
2H2(g)+O2(g)△H=+285.5k?Jmol﹣1
B.反应SO2(g)+2H2S(g)═3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=﹣38.6k?Jmol﹣1
D.由C(石墨,s)=C(金刚石,s)△H=+1.90 k?Jmol﹣1可知,金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国“蛟龙”号载入潜水器进行第五次下潜试验,最大深度达到7062米,并完全返回.其动力电源是Al﹣AgO电池,原理如图所示.下列说法中正确的是( ) 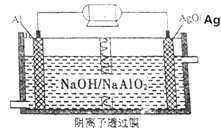
A.Al电极是该电池的正极
B.Ag在AgO/Ag电极上发生氧化反应
C.该电池负极反应是2Al﹣6e﹣+8OH﹣═2AlO2﹣+4H2O
D.AgO/Ag电极溶液中的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机酸转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池的负极反应为( )
A. H2-2e-+2OH-=2H2O B. O2+4e-+4H+=2H2O
C. H2-2e-=2H+ D. O2+4e-+2H2O=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com