
����Ŀ��������A�����ڲ�ͬ�Ķ�����Ԫ��X��Y��ɣ������õ����ȳ�����ϡ�
��1��X�ĵ��ʼȿ������ᷴӦ���ֿ���NaOH��Һ��Ӧ��X��ԭ�ӽṹʾ��ͼΪ___________��
��2��X����������Һ�����NaOH��Һ��Ӧ�����ӷ���ʽΪ__________________��
��3��һ�������£�A��ˮ�����������ɺ�Y�Ļ�����Z��Z���Ӻ���10�����ӡ�
��Z��H2O2��Ӧ�������֮һ��Y�ĵ��ʣ�Y�ĵ��ʵĵ���ʽΪ_____________��Z���ӵĽṹ��____________��
��A�Ļ�ѧʽ��_____________��
��4��X�ĵ��ʡ�ʯī�Ͷ������ѣ�TiO2����������ϣ������·�Ӧ�õ��Ļ������������Ԫ����ɣ��Ҷ��������մɲ��ϣ��ڻ���͵���������ҪӦ�ã����䷴Ӧ�Ļ�ѧ����ʽ��
____________________��
���𰸡�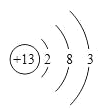
![]()
![]() ������ AlN
������ AlN 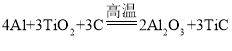
��������
X�ĵ��ʼȿ������ᷴӦ���ֿ���NaOH��Һ��Ӧ��XΪAlԪ�أ�A��ˮ�����������ɺ�Y�Ļ�����Z��Z���Ӻ���10�����Ӹ����ӣ������Ʋ�Z��һ���⻯��������⻯����NH3��CH4��HF�ȣ�Z��H2O2��Ӧ�������֮һ��Y�ĵ��ʣ���Z��NH3��YΪNԪ�ء�
��1��XΪAl����ԭ�ӽṹʾ��ͼΪ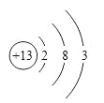 ��
��
��2���÷�Ӧ�����ӷ���ʽΪ��![]() ��
��
��3������������Y�ĵ���ΪN2�������ʽΪ![]() ��ZΪNH3������ӹ���Ϊ�����Σ�
��ZΪNH3������ӹ���Ϊ�����Σ�
��A�������õ����ȳ�����ܣ������ϼ���Ԫ����Al���ɵĻ���������ֻ��N��Al����AlN��
��4����������Եø÷�Ӧ�Ļ�ѧ����ʽΪ��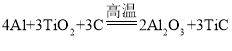 ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ӦX��g��![]() 4Y��g�� +Z��g�� ��H< 0����ij�¶�ʱX��Ũ����ʱ��仯�����ߣ�
4Y��g�� +Z��g�� ��H< 0����ij�¶�ʱX��Ũ����ʱ��仯�����ߣ�

�����йظ÷�Ӧ��������ȷ���ǣ� ��
A. ��6min��Ӧ����ֹ��
B. X��ƽ��ת����Ϊ85��
C. �������¶ȣ�X��ƽ��ת���ʽ�����85��
D. �������¶ȣ�v����v������ͬ��������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧ��Ӧԭ���о��������ȵ��ʼ��仯����ķ�Ӧ����Ҫ���塣
��1���ϳɰ���Ӧ��ӦN2(g)+3H2(g)![]() 2NH3(g)�����ں��¡���ѹ��������ƽ����ϵ��ͨ�������ƽ��_______�ƶ�����������������������������������ʹ�ô���_____��Ӧ����H����������������С���������ı�������
2NH3(g)�����ں��¡���ѹ��������ƽ����ϵ��ͨ�������ƽ��_______�ƶ�����������������������������������ʹ�ô���_____��Ӧ����H����������������С���������ı�������
��2��O2(g)= O+2(g)+e- ![]() H1=1175.7kJ��mol-1
H1=1175.7kJ��mol-1
PtF6(g)+ e-1![]() PtF6-(g)
PtF6-(g)![]() H2= -771.1 kJ��mol-1
H2= -771.1 kJ��mol-1
O2+PtF6-(s)=O2+(g)+PtF6- ![]() H3=482.2 kJ��mol-1
H3=482.2 kJ��mol-1
��ӦO2��g��+ PtF6 (g) = O2+PtF6- (s)��![]() H=_____________ kJ��mol-1��
H=_____________ kJ��mol-1��
��3����25���£���Ũ�Ⱦ�Ϊ0.1 mol��L-1��MgCl2��CuCl2�����Һ����μ��백ˮ��������__________�������ѧʽ�������ɸó��������ӷ���ʽΪ____________����֪25��ʱKsp[Mg(OH)2]=1.8��10-11,KsP[Cu(OH)2]=2.2��10-20��
��4����25���£���a mol��L-1�İ�ˮ��0.01 mol��L-1������������ϣ���Ӧƽ��ʱ��Һ��c(NH4+)=c(Cl-)������Һ��_____________�ԣ����������������������������ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ��볣��Kb=__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̬����̬��ֱ���������Ӧ���Ȼ�ѧ����ʽ���£�
��H2(g)+I2(��)2HI(g)��H=-9.48kJmol-1
��H2(g)+I2(��)2HI(g)��H=+26.48kJmol-1
�����жϲ���ȷ����(����)
A.![]() �е�I2Ϊ��̬��
�е�I2Ϊ��̬��![]() �е�I2Ϊ��̬
�е�I2Ϊ��̬
B.![]() �ķ�Ӧ����������
�ķ�Ӧ����������![]() �ķ�Ӧ��������
�ķ�Ӧ��������
C.1mol��̬������ʱ������35.96kJ
D.��Ӧ![]() �IJ���ȷ�Ӧ
�IJ���ȷ�Ӧ![]() �IJ������ȶ��Ը���
�IJ������ȶ��Ը���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͪ��һ����Ҫ�Ļ���ԭ�ϣ�ʵ���ҳ������з����Ʊ�����ͪ��
![]()
������������ͪ��ˮ�IJ����������ʼ��±���
���� | �е㣨���� | �ܶȣ�g��cm��3��20���� | �ܽ��� |
������ | 161.1��97.8���� | 0.9624 | ������ˮ |
����ͪ | 155.6��95���� | 0.9478 | ����ˮ |
ˮ | 100.0 | 0.9982 |
�������е����ݱ�ʾ���л�����ˮ�γɵľ��й̶���ɵĻ����ķе�
��1������Na2Cr2O7��Һ������������Ӧ����H<0����Ӧ���ҽ�������ϵ�¶�Ѹ������������Ӧ���ࡣʵ���н�����Na2Cr2O7��Һ�ӵ�ʢ�л��������ձ��У���55~60�����з�Ӧ��
��Ӧ��ɺ�������ˮ�������ռ�95~100������֣��õ���Ҫ������ͪ��ˮ�Ļ���
������Na2Cr2O7��Һ�ļ��Ϸ�ʽΪ_______________��
�������ܷ��뻷��ͪ��ˮ��ԭ����_______________��
��2������ͪ���ᴿ��Ҫ��������һϵ�еIJ�����
a. �����ռ�151~156������֣� b. ���ˣ�
c. ���ռ���������м�NaCl ���������ͣ����ã���Һ��
d. ������ˮMgSO4���壬��ȥ�л����е�����ˮ��
��������������ȷ˳����________������ĸ����
����������b��c��ʹ�õIJ����������ձ�����ƿ���������⣬����__________��
������������c������NaCl �����������____________��
��3�����ú˴Ź��������Լ����Ʊ��IJ����Ƿ�Ϊ����ͪ������ͪ��������___�ֲ�ͬ��ѧ��������ԭ�ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������кϳɰ���ӦN2+3H2![]() 2NH3�ﵽƽ������¶Ȳ��䣬���������ݻ�ѹ��Ϊԭ����1/2���ﵽ��ƽ�����ԭƽ����Ƚϣ�����˵������ȷ����
2NH3�ﵽƽ������¶Ȳ��䣬���������ݻ�ѹ��Ϊԭ����1/2���ﵽ��ƽ�����ԭƽ����Ƚϣ�����˵������ȷ����
A. �����ڵ���ѹǿΪԭ����2�� B. N2��Ũ�ȱ�ԭ��ƽ��Ũ��С
C. H2��ת����Ϊԭ����2�� D. ������ܶ�Ϊԭ����2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��300 ��ʱ����2 mol A��2 mol B������������2 L�ܱ������У��������·�Ӧ��3A(g)��B(g) ![]() 2C(g)��2D(g)����H��Q,2 minĩ�ﵽƽ�⣬����0.8 mol D��
2C(g)��2D(g)����H��Q,2 minĩ�ﵽƽ�⣬����0.8 mol D��
��1��300 ��ʱ���÷�Ӧ��ƽ�ⳣ������ʽΪ��K ��__________����֪K300 ��<K350 ��������H______0(����������������)��
��2����2 minĩʱ��B��ƽ��Ũ��Ϊ________��D��ƽ����Ӧ����Ϊ________��
��3�����¶Ȳ��䣬��С�����ݻ�����A��ת����______(��������������С������������ ) ��ԭ���� _______��
��4���������ͬ�������£�������Ӧ���淴Ӧ������У���ʼʱ����C��D��![]() mol����ʹƽ��ʱ�����ʵ����ʵ���Ũ����ԭƽ����ͬ����Ӧ�ü���B_________mol��
mol����ʹƽ��ʱ�����ʵ����ʵ���Ũ����ԭƽ����ͬ����Ӧ�ü���B_________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾA��B��C��D��E����������
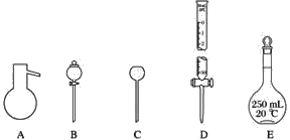
(1)��ѡ�������������Ƶ���ţ�������Ӧ�ĺ����ϣ�
��������ƿ���ڼ�ʽ�ζ��ܡ���Բ����ƿ���ܳ���©���ݷ�Һ©��������ʽ�ζ��ܡ�������ƿ
A��__________��B��__________��C��__________��D��________��E��________��
(2)����A��E���������У�ʹ��ǰ�����©����________����װ���巢��������Һ�����________��
(3)����������
![]()
�����չ�������ʱ�����õ���������________________(������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����úת��Ϊˮú������Ҫ��ѧ��ӦΪC(s)��H2O(g)=CO(g)��H2(g)��C(s)��CO(g)��H2(g)��ȫȼ�յ��Ȼ�ѧ����ʽΪ��
C(s)��O2(g)=CO2(g)����H=��393.5 kJ��mol��1
H2(g)��![]() O2(g)=H2O(g)����H=��242.0 kJ��mol��1
O2(g)=H2O(g)����H=��242.0 kJ��mol��1
CO(g)��![]() O2(g)=CO2(g)����H=��283.0 kJ��mol��1
O2(g)=CO2(g)����H=��283.0 kJ��mol��1
��ش�
�����������ݣ�д��C(s)��ˮ������Ӧ���Ȼ�ѧ��Ӧ����ʽ��_____________________________.
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com