
【题目】运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应反应N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______移动(填“向左”“向右”或“不”);,使用催化剂_____反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______移动(填“向左”“向右”或“不”);,使用催化剂_____反应的ΔH(填“增大”“减小”或“不改变”)。
(2)O2(g)= O+2(g)+e- ![]() H1=1175.7kJ·mol-1
H1=1175.7kJ·mol-1
PtF6(g)+ e-1![]() PtF6-(g)
PtF6-(g)![]() H2= -771.1 kJ·mol-1
H2= -771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- ![]() H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的![]() H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
【答案】向左 不改变 -77.6 Cu(OH)2 Cu2++2NH3·H2O=Cu(OH)2 ↓+2NH4+ 中 Kb=10-9/( (a-0.01)mol·L-1
【解析】
(1)在恒压条件下加入氩气,则容积增大,导致原平衡中各物质的浓度同等比例减小,所以平衡向气体体积增大的方向即向左移动;催化剂仅是改变化学反应速率,不会影响焓变。
因此,本题正确答案为:向左;不改变;
(2)已知①O2(g)= O+2(g)+e- ΔH1=1175.7kJ·mol-1;
②PtF6(g)+ e-![]() PtF6-(g) ΔH2= -771.1 kJ·mol-1;
PtF6-(g) ΔH2= -771.1 kJ·mol-1;
③O2+PtF6-(s)=O2+(g)+PtF6- ΔH3=482.2 kJ·mol-1;
根据盖斯定律,将化学方程式①+②-③叠加得到:O2(g)+ PtF6(g) = O2+PtF6-(s) ΔH=-77.6kJ·mol-1
因此,本题正确答案为:-77.6;
(3)Cu(OH)2 的Ksp小于Mg(OH)2的,所以离子的浓度商首先大于Cu(OH)2 的而先沉淀;由于氨水是弱碱,书写离子方程式时不能拆开。
因此,本题正确答案为:Cu(OH)2;Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+;
(4)由溶液的电荷守恒可得: c(H*)+c(NH4*)=c(Cl-)+c(OH-),已知c(NH4*)=c(Cl-),则有c(H*)=c(OH-),溶液显中性;电离常数只与温度有关,则此时NH3·H2O的电离常数Kb=[c(NH4*)·c(OH-)]/c(NH3·H2O)=" (0.01" mol·L-1·10-7mol·L-1)/(amol·L-1-0.01 mol·L-1)= 10-9/( (a-0.01)mol·L-1。
因此,本题正确答案为:中;Kb=10-9/( (a-0.01)mol·L-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下:
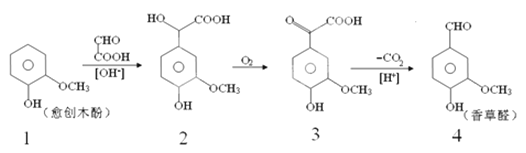
下列说法正确的是( )
A. 反应1→2属于加成反应,且生成的化合物2具有一个手性碳原子
B. 化合物2在一定条件下可发生消去反应
C. 检验制得的香草醛中是否混有化合物3,可用氯化铁溶液
D. 等物质的量四种化合物分别与足量NaOH反应,消耗NaOH物质的量之比为1:3:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+)________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH4+)。
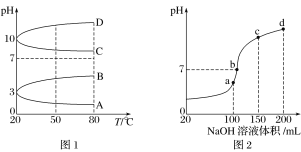
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填字母)。
②室温时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=________mol·L-1(填数值表达式)。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是____________;在b点,溶液中各离子浓度由大到小的排列顺序是______________。
Ⅱ.pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg10-3=3。已知H2CO3溶液中存在下列平衡:CO2+H2O![]() H2CO3、H2CO3
H2CO3、H2CO3![]() H++HCO3-、HCO3-
H++HCO3-、HCO3-![]() H++CO32-图3为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图。请回答下列问题:
H++CO32-图3为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图。请回答下列问题:

(1)在pH=9时,H2CO3溶液中浓度最大的含碳元素的离子为______。
(2)pH<4时,溶液中H2CO3的pC总是约等于3的原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]____________;下列状态的铝元素中,电离最外层的一个电子所需能量最小的是______________(填标号)。
A.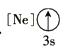 B.
B.![]() C.
C.![]() D.
D.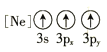
(2)8—羟基喹啉合铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与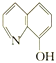 8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表格中卤化物的熔点产生差异的原因是_______________________________________________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6分子,分子中每个原子最外层均达到8电子,二聚体Al2Cl6的结构式为______________________________;其中Al的配位数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)![]() 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | b |
915 | c | 75.0 | d |
1000 | e | f | 83.0 |
①b<f ②915℃、2.0MPa时E的转化率为60% ③该反应的ΔS>0 ④K(1000℃)>K(810℃)
上述①~④中正确的有( )
A.4个B.3个C.2个D.1个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A卷题.电子工业常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。从腐蚀废液(主要含FeCl3、FeCl2、CuCl2 )中回收铜,并重新获得FeCl3溶液。废液处理流程如下:
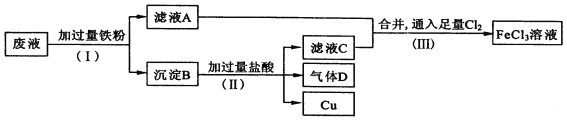
(1)步骤(Ⅰ)中分离溶液和沉淀的操作名称是____________________;
(2)沉淀B中主要含有铁和__________,气体D是_________________;
(3)写出步骤(Ⅲ)中生成FeCl3的化学方程式_____________________________;
(4)取少量最终所得溶液滴加____________(填“KSCN溶液”或“稀硫酸”),溶液呈红色,证明有Fe3+存在;写出该反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )

下列图示与对应的叙述符合的是( )
A.图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B.图乙表示反应2SO2(g)+O2(g) ![]() 2SO3(g)△H<0的平衡常数K与温度和压强的关系
2SO3(g)△H<0的平衡常数K与温度和压强的关系
C.图丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中 随HCl溶液体积变化关系
随HCl溶液体积变化关系
D.图丁表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A.78g Na2O2固体含有离子的数目为4NA
B.由水电离出的c(H+)=1012mol·L1溶液中Na+、NH4+、SO42、NO3 一定能大量共存
C.硫酸酸化的KI淀粉溶液久置后变蓝的反应为:4I+O2+4H+=2I2+2H2O
D.将充有NO2的玻璃球浸到热水中气体颜色加深说明2NO2(g)![]() N2O4(g) △H >0
N2O4(g) △H >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求对如图中两极进行必要的联接并填空:
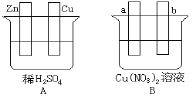
(1)在A图中,使铜片上冒H2气泡。请加以必要联接___,则联接后的装置叫___。电极反应式:锌板:___;铜板:___。
(2)在B图中(a、b均为惰性电极),使a极析出铜,则b析出:___。加以必要的联接后,该装置叫___。电极反应式,a极:___,b极:___。经过一段时间后,停止反应并搅均溶液,溶液的pH值___(升高、降低、不变),加入一定量的___后,溶液能恢复至与电解前完全一致。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com