
【题目】按要求对如图中两极进行必要的联接并填空:
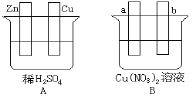
(1)在A图中,使铜片上冒H2气泡。请加以必要联接___,则联接后的装置叫___。电极反应式:锌板:___;铜板:___。
(2)在B图中(a、b均为惰性电极),使a极析出铜,则b析出:___。加以必要的联接后,该装置叫___。电极反应式,a极:___,b极:___。经过一段时间后,停止反应并搅均溶液,溶液的pH值___(升高、降低、不变),加入一定量的___后,溶液能恢复至与电解前完全一致。
【答案】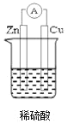 原电池 Zn-2e-=Zn2+ 2H++2e-=H2↑ O2 电解池 Cu2++2e-=Cu 2H2O4e=O2↑+4H+ 降低 CuO或者CuCO3
原电池 Zn-2e-=Zn2+ 2H++2e-=H2↑ O2 电解池 Cu2++2e-=Cu 2H2O4e=O2↑+4H+ 降低 CuO或者CuCO3
【解析】
(1)在A图中,使铜片上冒H2气泡,该装置必须形成闭合回路,该装置应该为原电池,且Cu作正极,Zn作负极,负极上锌失电子生成锌离子,正极上氢离子得电子生成氢气;
(2)在B图中(a、b均为惰性电极),使a极析出铜,该装置应该是电解池,a电极上铜离子放电生成Cu,b电极上水电离的氢氧根离子失电子生成氧气,且b电极有H+生成导致溶液pH降低,要使混合溶液恢复原状,根据“析出什么加入什么”的原则判断加入物质。
(1)要使该装置中Cu片上生成氢气,必须形成闭合回路,该装置应为原电池,装置图如图所示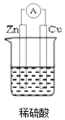 ,Zn作负极、Cu作正极,负极反应式为Zn2e=Zn2+、正极反应式为2H++2e=H2↑;
,Zn作负极、Cu作正极,负极反应式为Zn2e=Zn2+、正极反应式为2H++2e=H2↑;
故答案为: ;原电池;Zn2e=Zn2+;2H++2e=H2↑;
;原电池;Zn2e=Zn2+;2H++2e=H2↑;
(2)B图中(a、b均为惰性电极),使a极析出铜,a电极上铜离子放电生成Cu,该装置应为电解池,则b电极上H2O电离的氢氧根离子失电子生成氧气,所以析出O2,a、b电极反应式分别为Cu2++2e=Cu、2H2O4e=O2↑+4H+,有氢离子生成导致溶液pH减小,实际上相当于析出CuO,要使混合溶液恢复原状,应该加入CuO或者CuCO3;
故答案为:O2;电解池;Cu2++2e=Cu;2H2O4e=O2↑+4H+;降低;CuO或者CuCO3。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应反应N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______移动(填“向左”“向右”或“不”);,使用催化剂_____反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______移动(填“向左”“向右”或“不”);,使用催化剂_____反应的ΔH(填“增大”“减小”或“不改变”)。
(2)O2(g)= O+2(g)+e- ![]() H1=1175.7kJ·mol-1
H1=1175.7kJ·mol-1
PtF6(g)+ e-1![]() PtF6-(g)
PtF6-(g)![]() H2= -771.1 kJ·mol-1
H2= -771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- ![]() H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的![]() H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
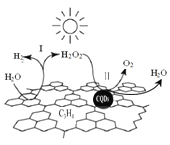
A. C3N4中C的化合价为 -4
B. 反应的两个阶段均为吸热过程
C. 阶段Ⅱ中,H2O2既是氧化剂,又是还原剂
D. 通过该反应,实现了化学能向太阳能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:Zn(s) +![]() O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
Hg(l) +![]() O2(g) = HgO(s) ΔH2=-90.7kJ/mol
O2(g) = HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3,其中ΔH3的值是
A.-260.4 kJ/molB.-254.6 kJ/molC.-438.9 kJ/molD.-441.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仅用下表提供的仪器![]() 夹持仪器和试剂任选
夹持仪器和试剂任选![]() 不能达到相应实验目的一组是
不能达到相应实验目的一组是
选项 | 实验目的 | 仪器 |
A | 用CCl4提取溴水中的溴单质 | 烧杯、玻璃棒、分液漏斗 |
B | 从食盐水中获得NaCl晶体 | 酒精灯、玻璃棒、坩埚、泥三角 |
C | 配制100mL1.0mol/L的NaOH溶液 | 药匙、天平、量筒、烧杯、玻璃棒、胶头滴管、100mL的容量瓶 |
D | 用盐酸除去BaSO4中混有少量BaCO3 | 漏斗、烧杯、玻璃棒、胶头滴管、滤纸 |
A. B. C. D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,加压有利于氨的合成
D.Fe(SCN)3溶液中加入NaOH后溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论均正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 取少量Na2SO3固体于试管中,加水溶解,滴加Ba(NO3)2溶液,再滴加稀硝酸 | 滴加Ba(NO3)2溶液,产生白色沉淀,再滴加稀硝酸,沉淀不溶解 | Na2SO3固体已经变质 |
B | 将SO2通入酸性KMnO4溶液中 | 溶液的紫红色褪去 | SO2具有漂白性 |
C | 将铁片投入浓硫酸中 | 无明显变化 | 常温下铁不与浓硫酸反应 |
D | 将10mL2mol/L的KI溶液与1mL1mol/LFeCl3溶液混合充分反应后滴加KSCN溶液 | 溶液颜色变红 | KI与FeCl3的反应具有可逆性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下进行合成氨的反应N2(g)+3H2(g) ![]() 2NH3(l),根据下列在相同时间内测定的结果判断生成氨的速率最快的是( )
2NH3(l),根据下列在相同时间内测定的结果判断生成氨的速率最快的是( )
A.v(H2)=0.1mol/(L·min)B.v(N2)=0.1mol/(L·min)
C.v(N2)=0.2mol/(L·min)D.v(NH3)=0.3mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)
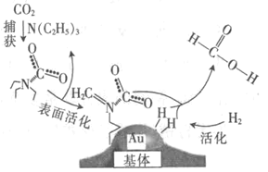
A.标准状况下,22.4 L CO2中所含的电子数目为16NA
B.10.1 g N(C2H5)3中所含的极性共价键数目为2.1NA
C.2 mol Au与2 mol H2中所含的分子数目均为2NA
D.100 g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com