
【题目】仅用下表提供的仪器![]() 夹持仪器和试剂任选
夹持仪器和试剂任选![]() 不能达到相应实验目的一组是
不能达到相应实验目的一组是
选项 | 实验目的 | 仪器 |
A | 用CCl4提取溴水中的溴单质 | 烧杯、玻璃棒、分液漏斗 |
B | 从食盐水中获得NaCl晶体 | 酒精灯、玻璃棒、坩埚、泥三角 |
C | 配制100mL1.0mol/L的NaOH溶液 | 药匙、天平、量筒、烧杯、玻璃棒、胶头滴管、100mL的容量瓶 |
D | 用盐酸除去BaSO4中混有少量BaCO3 | 漏斗、烧杯、玻璃棒、胶头滴管、滤纸 |
A. B. C. D.
【答案】B
【解析】
A.提取溴水中的溴单质采用萃取、分液装置,而萃取和分液的仪器是分液漏斗和烧杯,用提供的仪器能达到相应实验目的,A不符合题意;
B.从食盐水中获得NaCl晶体应该采用蒸发结晶的方法,进行蒸发时需用到酒精灯加热,需用蒸发皿、三脚架,要使用玻璃棒不断搅拌,以防液体溅出,蒸发完毕后移动蒸发皿须用坩埚钳,据以上分析可知提供的仪器中还缺少三脚架,用提供的仪器不能达到相应实验目的,B符合题意;
C.配制一定物质的量浓度溶液的步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,所以该实验所需仪器有:天平、药匙、烧杯、玻璃棒、胶头滴管、100mL容量瓶,用提供的仪器能达到相应实验目的,C不符合题意;
D.碳酸钡和稀盐酸反应生成可溶性的氯化钡,硫酸钡与稀盐酸不反应,然后采用过滤方法分离,最后洗涤、干燥即可,需要的仪器是:漏斗、烧杯、胶头滴管、滤纸,用提供的仪器能达到相应实验目的,D不符合题意;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)![]() 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | b |
915 | c | 75.0 | d |
1000 | e | f | 83.0 |
①b<f ②915℃、2.0MPa时E的转化率为60% ③该反应的ΔS>0 ④K(1000℃)>K(810℃)
上述①~④中正确的有( )
A.4个B.3个C.2个D.1个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日诺贝尔化学奖授予对锂电池方面研究有贡献的三位科学家。磷酸铁锂电池是绿色环保型电池,电池的总反应为:Li1-xFePO4+LixC6= LiFePO4+C6。磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。
(1)基态Li原子中,核外电子排布式为_______,占据的最高能层的符号是_______。
(2)该电池总反应中涉及第二周期的元素的第一电离能由大到小的顺序是_______(用元素符号表示)。
(3)FeCl3和LiFePO4中的铁元素显+3、+2价,请从原子结构角度解释Fe为何能显+3、+2价_______。
(4)苯胺(![]() )与甲苯(
)与甲苯(![]() )的相对分子质量相近,但苯胺的熔点(5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(95.0℃)、沸点(110.6℃), 原因是_______。
)的相对分子质量相近,但苯胺的熔点(5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(95.0℃)、沸点(110.6℃), 原因是_______。
(5)NH4H2PO4中,NH4+的空间构型为_______。与PO43-互为等电子体的分子或离子有_______(写两种),PO43-中磷原子杂化轨道类型为_______。
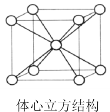
(6)锂晶体为A2型密堆积即体心立方结构(见图),晶胞中锂的配位数为_______。若晶胞边长为a pm,则锂原子的半径r为_______ pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断错误的是( )

A. 反应①、②、③都属于氧化还原反应 B. X、Y、Z、W四种元素中,Y的原子半径最小
C. Na着火时,可用甲扑灭 D. 一定条件下,x与甲反应生成丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。
(1)下图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。

在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
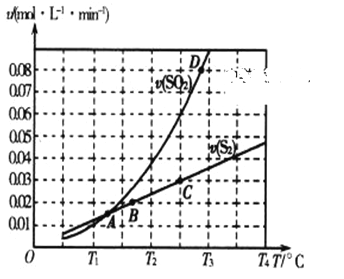
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
(3)用氨水吸收SO2。25℃时,将含SO2的烟气通入一定浓度的氨水中,当溶液显中性时,溶液中的![]() =_____________。(已知25℃,Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8 )
=_____________。(已知25℃,Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8 )
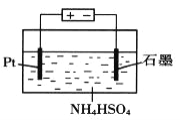
(4)当吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如图所示装置电解所得NH4HSO4溶液可制得强氧化剂(NH4)2S2O8,请写出电解NH4HSO4溶液的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求对如图中两极进行必要的联接并填空:
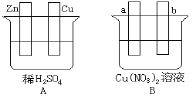
(1)在A图中,使铜片上冒H2气泡。请加以必要联接___,则联接后的装置叫___。电极反应式:锌板:___;铜板:___。
(2)在B图中(a、b均为惰性电极),使a极析出铜,则b析出:___。加以必要的联接后,该装置叫___。电极反应式,a极:___,b极:___。经过一段时间后,停止反应并搅均溶液,溶液的pH值___(升高、降低、不变),加入一定量的___后,溶液能恢复至与电解前完全一致。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.氢气的燃烧热为 △H =-285.5 kJ·mol-1,则电解水的热化学方程式为2H2O(1)![]() 2H2(g)+O2(g) △H =+285.5 kJ·mol-1
2H2(g)+O2(g) △H =+285.5 kJ·mol-1
B.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量,则Fe(s)+S(s) ===FeS(s) △H =-95.6 kJ·mol-l
C.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2 (g)+3H2 (g) ![]() 2NH3 (g)△H =-38.6 kJ·mol-l
2NH3 (g)△H =-38.6 kJ·mol-l
D.相同条件下,在两个相同的恒容密闭容器中,1 mol N2和3 mol H2反应放出的热量与2 mol NH3分解吸收的热量一定一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:2H2(g)+O2(g)=2H2O(g)ΔH=-483.6 kJ·mol-1,H2(g)+![]() O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1,2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热是( )
O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1,2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热是( )
A.483.6 kJ·mol-1B.241.8 kJ·mol-1C.571.6 kJ·mol-1D.285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸又名乙二酸,广泛存在于植物源食品中,它的用途非常广泛。测定某草酸晶体(组成为H2C2O4·nH2O)中H2C2O4的质量分数,进行下列实验:①取 w g 草酸晶体配成 250mL 溶液;②取 25.00mL 所配草酸溶液置于锥形瓶中, 加入适量稀H2SO4 后,在锥形瓶底部垫一张白纸,用浓度为 0.100mol·L-1KMnO4 溶液滴定。滴定时,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
请回答下列问题:
(1)上述反应的还原剂是_____(填化学式)。
(2)步骤①中为配制准确浓度的草酸溶液,所需用到的仪器有:天平(含砝码)、烧杯、药匙、250ml 容量瓶和___________ 、_______________。
(3)在锥形瓶底部垫一张白纸的作用是_____。
(4)滴定管应选用_______式滴定管(填“酸”或“碱”),判断滴定结束的标准是_________。
(5)三次滴定所用 KMnO 溶液体积平均为 20.00mL,则实验测得所配草酸溶液的物质的量浓度为______________mol·L-1;草酸晶体中 H2C2O4 的质量分数为_______________;在实验过程中,锥形瓶用蒸馏水洗净之后,再用草酸溶液润洗,对测定结果造成的影响是_______(填“偏大”、“偏小”或“无影响)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com