
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。
(1)下图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。

在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
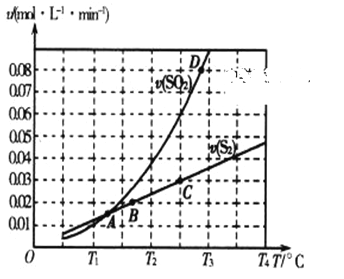
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
(3)用氨水吸收SO2。25℃时,将含SO2的烟气通入一定浓度的氨水中,当溶液显中性时,溶液中的![]() =_____________。(已知25℃,Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8 )
=_____________。(已知25℃,Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8 )
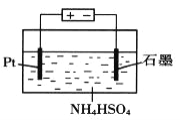
(4)当吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如图所示装置电解所得NH4HSO4溶液可制得强氧化剂(NH4)2S2O8,请写出电解NH4HSO4溶液的化学方程式_______________。
【答案】CH4(g)+2SO2(g)=2S(g)+CO2(g)+2H2O(g) △H=+352 kJ·mol-1 C < A 0.62 2NH4HSO4 ![]() (NH4)2S2O8+H2↑
(NH4)2S2O8+H2↑
【解析】
(1)根据图像信息结合盖斯定律进行推算;
(2) ①达到平衡状态时,不同物质表示的正逆反应速率之比等于化学计量数之比,据此进行判断;
②从图像可出,升高温度,SO2的生成速率增加较快,反应逆向移动,该反应为放热反应,△H<0;
③A、针对于可逆反应2C(s)+2SO2(g)![]() S2(g)+2CO2(g),△H<0;降低温度,平衡右移,SO2平衡转化率增大;
S2(g)+2CO2(g),△H<0;降低温度,平衡右移,SO2平衡转化率增大;
B、C为纯固体,改变其用量,速率不变,平衡不移动,SO2平衡转化率不变;
C、减小容器体积,增大压强,平衡左移,SO2平衡转化率减小;
D、添加高效催化剂,只能加快反应速率,平衡不动,SO2平衡转化率不变;
(3)根据电离平衡常数的公式进行计算,Ka2(H2SO3)=![]() ,
,![]() =
=![]() ;
;
(4) NH4HSO4中硫元素为+6价,(NH4)2S2O8中硫元素为+7价,阳极SO42-失去电子发生氧化反应生成S2O82-,阴极H+得到电子被还原为氢气。
(1)根据图像可知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=Ea1-Ea2=126kJ/mol-928kJ/mol=-802kJ/mol;②S(s)+O2(g)=SO2(g)△H=-577 kJ/mol;根据盖斯定律可知①-②×2即得到CH4和SO2反应的热化学方程式为CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(g)△H=+352 kJ/mol;正确答案:CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(g) △H=+352 kJ/mol。
(2) ①达到平衡状态时,不同物质表示的正逆反应速率之比等于化学计量数之比;因此A点时,SO2的生成速率与S2(g)的生成速率相等,不符合化学计量数之比,没有达到平衡状态;B点时SO2的生成速率与S2(g)的生成速率不相等,但不符合化学计量数之比,没有达到平衡状态;C点SO2的生成速率与S2(g)的生成速率之比为2:1,符合化学计量数之比,达到平衡状态;D点时,SO2的生成速率与S2(g)的生成速率不是2倍关系,不符合化学计量数之比,没有达到平衡状态;答案选C;
②从图像可出,升高温度,SO2的生成速率增加较快,反应逆向移动,该反应为放热反应,△H<0;
③A、针对于可逆反应2C(s)+2SO2(g)![]() S2(g)+2CO2(g),△H<0;降低温度,平衡右移,SO2平衡转化率增大,选项A正确;
S2(g)+2CO2(g),△H<0;降低温度,平衡右移,SO2平衡转化率增大,选项A正确;
B、C为纯固体,改变其用量,速率不变,平衡不移动,SO2平衡转化率不变,选项B错误;
C、减小容器体积,增大压强,平衡左移,SO2平衡转化率减小,选项C错误;
D、添加高效催化剂,只能加快反应速率,平衡不动,SO2平衡转化率不变,选项D错误;
答案选A;
(3)25℃时,将含SO2的烟气通入该氨水中,当溶液显中性时,c(H+)=c(OH-)=10-7mol/L,亚硫酸氢根离子电离平衡常数Ka2(H2SO3)=![]() ,
,![]() =
=![]() =
=![]() =0.62;
=0.62;
() NH4HSO4中硫元素为+6价,(NH4)2S2O8中硫元素为+7价,阳极SO42-失去电子发生氧化反应生成S2O82-,阴极H+得到电子被还原为氢气,电解NH4HSO4溶液的化学方程式2NH4HSO4![]() (NH4)2S2O8+H2↑;正确答案:2NH4HSO4
(NH4)2S2O8+H2↑;正确答案:2NH4HSO4![]() (NH4)2S2O8+H2↑。
(NH4)2S2O8+H2↑。


科目:高中化学 来源: 题型:
【题目】O3是一种常见的绿色氧化剂,可由臭氧发生器(原理如图)电解稀硫酸制得。下列说法错误的是

A. 电极a为阴极
B. a极的电极反应为O2+4H++4e-===2H2O
C. 电解一段时间后b极周围的pH下降
D. 标准状况下,当有5.6LO2反应时,收集到O2和O3混合气体4.48L,O3的体积分数为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两个或两个以上的苯环以共有环边的方式相互稠合的多环芳香烃称为稠环芳香烃。下列椭圆烯也属于稠环芳香烃。
① 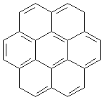 ②
② 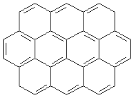
据此回答下列问题:
(1)已知椭圆烯①的分子式为C24 H12,则椭圆烯②的分子式为_________________。
(2)上述椭圆烯的一氯取代物各有几种同分异构体?①有_______种,②有_______种。
(3)假如上述椭圆烯可以和氢气在一定条件下发生加成反应生成饱和脂环烃,则加氢后的生成物分子中所有的碳原子是否仍在同一平面内?____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法的是
A.合金具有优良性能,可用于制造新型金属材料
B.氧化铁俗称铁红,可用作红色油漆和外墙涂料
C.二氧化硫具有漂白性,常用来漂白食品
D.A12O3可用作耐高温材料,A1(OH)3可用于中和过多的胃酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计正确的是
A.将混有HC1气体的CO2通入装有饱和碳酸钠溶液的洗气瓶,可除去HC1
B.用向上排空气法收集铜粉与稀硝酸反应产生的NO
C.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
D.将SO2通入KMnO4酸性溶液证明SO2具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以浓缩海水为原料提取溴的部分流程如右图:下列说法正确的是
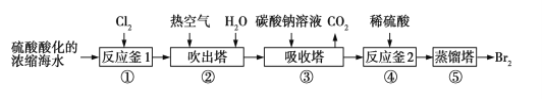
A. 海水需要浓缩,是因为海水中的Br2含量较低
B. 热空气的作用是将多余的Cl2吹出
C. 吸收塔中发生的反应是3Br2+3CO32-=5Br-+BrO3-+3CO2↑
D. 反应釜2中发生的反应是5Br-+BrO3-+3H2O=3Br2+6OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C2H4O2的有机化合物A具有如下性质:
①A+Na → 迅速产生气泡;
②A+CH3CH2OH ![]() 有香味的物质。
有香味的物质。
(1)根据上述信息,对该化合物可做出的判断是_________(填字母)。
A.一定含有—OH B.一定含有—COOH
C.有机化合物A为乙醇 D.有机化合物A为乙酸
(2)A与金属钠反应的化学方程式为_____________
(3)化合物A和CH3CH2OH反应生成的有香味的物质的结构简式为_______________。
(4)有机化合物B的分子式为C2H4O3,与Na反应迅速产生H2,且1 mol B与足量Na反应放出1 mol H2,则B的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A与B反应生成C,假定反应由A、B开始,它们的初始浓度均为1.0mol·L-1。反应进行2min后A的浓度为0.8 mol·L-1,B的浓度为0.6 mol·L-1,C的浓度为0.6 mol·L-1。
⑴2min内的平均速率为V(A)=_________,V(B)=________,V(C)=________;
⑵V(A):V(B):V(C)=___________________;
⑶该反应的化学方程式为:_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com