
����Ŀ�����������������ϵı����Թ��л��ߵķ�ʽ����ϵĶ��������Ϊ������������������ԲϩҲ���ڳ�����������
�١�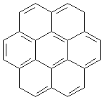 ���� �ڡ�
���� �ڡ�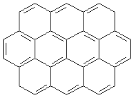
�ݴ˻ش��������⣺
(1)��֪��Բϩ�ٵķ���ʽΪC24 H12������Բϩ�ڵķ���ʽΪ_________________��
(2)������Բϩ��һ��ȡ������м���ͬ���칹��?����_______�֣�����_______�֡�
(3)����������Բϩ���Ժ�������һ�������·����ӳɷ�Ӧ���ɱ���֬���������������������������е�̼ԭ���Ƿ�����ͬһƽ����?____________________��
���𰸡�C32H1434��
��������
��1�����ݢ�Ľṹ��ʽ�ж������ʽ����2�������Գ���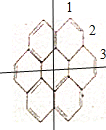 ��
��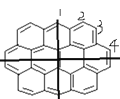 ��������ЧHԭ�����࣬��Ч��ԭ����Ŀ��һ�ȴ����������ͬ����3�����ݼ������������ṹ�жϡ�
��������ЧHԭ�����࣬��Ч��ԭ����Ŀ��һ�ȴ����������ͬ����3�����ݼ������������ṹ�жϡ�
��1�����ݢ�Ľṹ��ʽ��֪����ķ���ʽ�к���32��C��12��H�������ʽΪ��C32H12����2��������ĶԳ��� ��֪����ṹ��ʽ�к���3��Hԭ������һ�ȴ�����3�֣�������ĶԳ���
��֪����ṹ��ʽ�к���3��Hԭ������һ�ȴ�����3�֣�������ĶԳ��� ����֪�����ԭ������Ϊ4�֣���ͼ��ʾ�������Ԣ��һ�ȴ������ĿΪ4����3������������Բϩ����Ժ�������һ�������·����ӳɷ�Ӧ���ɱ���֬������ÿ��̼ԭ������4�����ţ����ݼ���ĽṹΪ���������֪�����������������������е�̼ԭ�ӿ϶�����ͬһƽ�档
����֪�����ԭ������Ϊ4�֣���ͼ��ʾ�������Ԣ��һ�ȴ������ĿΪ4����3������������Բϩ����Ժ�������һ�������·����ӳɷ�Ӧ���ɱ���֬������ÿ��̼ԭ������4�����ţ����ݼ���ĽṹΪ���������֪�����������������������е�̼ԭ�ӿ϶�����ͬһƽ�档


 ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
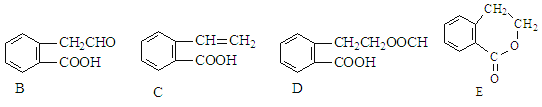
����Ŀ���л���A�Ľṹ��ʽΪ ![]() ������ͨ����ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D��E�������ʡ�
������ͨ����ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D��E�������ʡ�
��ش��������⣺
��1����A~E���������У���Ϊͬ���칹�����_______________(�����)��
��2��д�����з�Ӧ�Ļ�ѧ����ʽ�ͷ�Ӧ����
A��B:_______________________________________________����Ӧ���ͣ�__________
A��D:_______________________________________________����Ӧ���ͣ�__________
��3��Cͨ���Ӿ۷�Ӧ���γɸ߾���ø߾���Ľṹ��ʽΪ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����пƬ��ͭƬ����������ܡ���ֽ�����ߵ��ڲ���Ƭ�Ƴ���ͼ��ʾ��ԭ��أ�����ֽ�ô�����Һ��ʪʱ�������ܷ��⣮�����йظõ�ص�˵����ȷ����( )
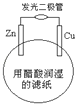
A. ͭƬ�ϵĵ缫��Ӧ��Cu �� 2e�� = Cu2+
B. пƬΪ��صĸ���
C. ���·�е�����ͭƬ����������пƬ
D. ��ع���ʱ����ֱ��ת��Ϊ��ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯��Ҫ���뻹ԭ������ʵ�ֵ���
A. Cl-��C12 B. HCO3- ��C032- C. Mn04- ��Mn2+ D. Zn��Zn2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��F��Cl��Br����VIIA��Ԫ�أ�����������Ԫ��ԭ��˵����ȷ����
A.ԭ�Ӱ뾶��F>C1>BrB.��������������ͬ
C.������Ӳ�������ͬD.����������������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̬����ɵĻ��������ȫȼ�պ����õ�CO2��H2O�����ʵ��������������ʵ����ı仯��ͼ��ʾ�������жԻ�������ж���ȷ����( )

��һ������ϩ ��һ���м��� ��һ���б���
��һ��û������ �ݿ����м��� ��������Ȳ
A. �٢�B. �ڢ�C. �ڢ�D. �ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֱ���ŷź�SO2���������γ����꣬Σ����������ҵ�ϳ����ô���ԭ���ͼ����շ�����SO2���塣
��1����ͼ��ʾ��1mol CH4��ȫȼ��������̬ˮ�������仯��1mol S(g)ȼ�յ������仯��

�ڴ��������£�CH4���Ի�ԭSO2���ɵ���S(g)��H2O(g)��CO2��д���÷�Ӧ���Ȼ�ѧ����ʽ________________________________________________________��
��2����̿����ԭ��������Ļ�ѧ����ʽΪ2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)��һ��ѹǿ�£���1L�ܱ������г��������Ľ�̿��1molSO2������Ӧ�����SO2������������S2(g)�������������¶ȱ仯�Ĺ�ϵ��ͼ��ʾ��
S2(g)+2CO2(g)��һ��ѹǿ�£���1L�ܱ������г��������Ľ�̿��1molSO2������Ӧ�����SO2������������S2(g)�������������¶ȱ仯�Ĺ�ϵ��ͼ��ʾ��
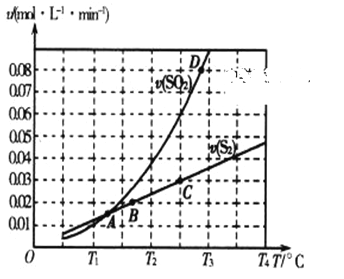
��A��B��C��D�ĵ��Ӧ��״̬�У��ﵽƽ��״̬����_____________(����ĸ)��
�ڸ÷�Ӧ�ġ�H_____0(�>����<����=��)��
�����д�ʩ�ܹ�����SO2ƽ��ת���ʵ���______________��
A�������¶� B������C���� C����С������� D�����Ӹ�Ч����
��3���ð�ˮ����SO2��25��ʱ������SO2������ͨ��һ��Ũ�ȵİ�ˮ�У�����Һ������ʱ����Һ�е�![]() =_____________��(��֪25�棬Ka1(H2SO3)=1.3��10-2��Ka2(H2SO3)=6.2��10-8 )
=_____________��(��֪25�棬Ka1(H2SO3)=1.3��10-2��Ka2(H2SO3)=6.2��10-8 )
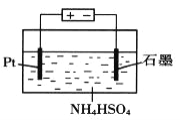
��4��������Һʧȥ����������ͨ��O2�ɵõ�NH4HSO4��Һ������ͼ��ʾװ�õ������NH4HSO4��Һ���Ƶ�ǿ������(NH4)2S2O8����д�����NH4HSO4��Һ�Ļ�ѧ����ʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NOCl,�۵�:-64.5 ��,�е�:-5.5 ��)��һ�ֻ�ɫ����,��ˮ��ˮ�⡣�����ںϳ���������ý�����м���ȡ�ʵ���ҿ���������һ�������ڳ��³�ѹ�ºϳɡ�
��1�������ͬѧ���Ʊ�ԭ����NO��Cl2,�Ʊ�װ������ͼ��ʾ:

Ϊ�Ʊ��������������,�±���ȱ�ٵ�ҩƷ��:
װ�â� | װ�â� | ||
��ƿ�� | ��Һ©���� | ||
�Ʊ�����Cl2 | MnO2 | ��___ | ��___ |
�Ʊ�����NO | Cu | ��___ | ��___ |
��2������ͬѧ���ü����Ƶõ�NO��Cl2�Ʊ�NOCl,װ����ͼ��ʾ:

��װ������˳��Ϊa��________(�������������ҷ���,��Сд��ĸ��ʾ)��
��װ�â��������ɽ�һ������NO��Cl2��,��һ��������____________��
��װ�â���������____________��
��װ�â�������β��ʱ,NOCl������Ӧ�Ļ�ѧ����ʽΪ________________��
��3������ͬѧ��������,�����ˮ��Ũ������Ũ����Ļ��ᣬһ�������¸û���������������Ⱥ������� �÷�Ӧ�Ļ�ѧ����ʽΪ__________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com