
【题目】O3是一种常见的绿色氧化剂,可由臭氧发生器(原理如图)电解稀硫酸制得。下列说法错误的是

A. 电极a为阴极
B. a极的电极反应为O2+4H++4e-===2H2O
C. 电解一段时间后b极周围的pH下降
D. 标准状况下,当有5.6LO2反应时,收集到O2和O3混合气体4.48L,O3的体积分数为80%
【答案】D
【解析】
本题结合电解池的新型应用,主要考查电解池相关知识。电解池左侧通入O2,由此可知,a极发生还原反应,a极为阴极,其电极反应式为:O2+4H++4e-=2H2O,故b为阳极,由此进行分析即可。
A.由上述分析可知,a为阴极,正确;
B.由上述分析可知,a极的电极反应为O2+4H++4e-=2H2O,正确;
C.b极为H2O电离出的OH-失去电子,生成O2和O3,电解一段时间后,b极附近水的电离平衡被破坏,溶液中H+浓度增大,pH下降,正确;
D.阴极0.25molO2反应时,转移电子为1mol,即阳极消耗0.5molH2O,生成混合气体为0.2mol,设生成O2为mmol,O3为nmol,由此可列出二元一次方程组:2m+3n=0.5,m+n=0.2,解得n=0.1,m=0.1,故O3的体积分数为![]() ,错误。答案选D。
,错误。答案选D。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】一定温度下在一定体积的密闭容器中,下列叙述不能作为可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡状态标志的是 ( )
2C(g)达到平衡状态标志的是 ( )
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1∶3∶2
A. ②⑧B. ④⑦C. ①③D. ⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式为 ![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。
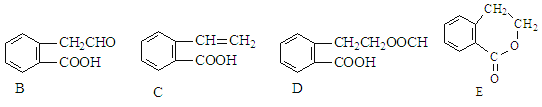
请回答下列问题:
(1)在A~E五种物质中,互为同分异构体的是_______________(填代号)。
(2)写出下列反应的化学方程式和反应类型
A→B:_______________________________________________,反应类型:__________
A→D:_______________________________________________,反应类型:__________
(3)C通过加聚反应能形成高聚物,该高聚物的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性.Cl2>Br2>I2 |
C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
D | 浓HNO3加热 | 有红棕色气体 | HNO3有强氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaCl溶液时,导致浓度偏高的原因可能是
A. 移液时,不慎将液体流到瓶外 B. 容量瓶盛过NaCl溶液,使用前未洗涤
C. 容量瓶中原有少量的蒸馏水 D. 定容时读数仰视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题越来越受到人们的重视,研究表明氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。
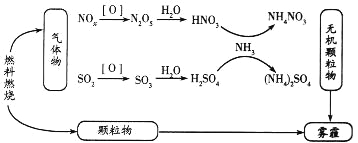
回答下列问题:
(1)NH3的电子式为____________,NH4NO3中含有的化学键是________________:
(2)下列关于雾霾的叙述错误的是________(填序号)
A.雾霾中含有硝酸铵和硫酸铵 B.NH3是形成无机颗粒物的催化剂
C.雾霾的形成与过度施用氮肥有关 D.雾霾的形成过程涉及氧化还原反应
(3)预防含硫化合物雾霾生成的方法之一是将氨气和二氧化硫通入水中,再充入O2充分反应生成一种正盐,该反应的化学方程式为________________________。预防含氮化合物雾霾生成的方法之一是用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸,电解后该溶液的pH_______(填“变大”“变小”或“不变”)。
(4)在有氧条件下,催化剂能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx混合气体匀速通入装有催化剂的反应器中反应,测得反应温度高于380℃时,NOx的去除率迅速下降,其原因之一是催化剂活性下降,另一重要原因是__________________________。在无氧条件下,反应器中NH3能将NO2还原为N2,当生成1mol N2时转移电子________mol(可用分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )
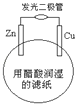
A. 铜片上的电极反应:Cu — 2e﹣ = Cu2+
B. 锌片为电池的负极
C. 外电路中电子由铜片经导线流向锌片
D. 电池工作时电能直接转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。
(1)下图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。

在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
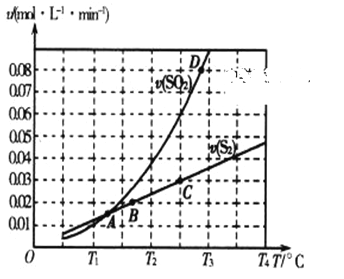
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
(3)用氨水吸收SO2。25℃时,将含SO2的烟气通入一定浓度的氨水中,当溶液显中性时,溶液中的![]() =_____________。(已知25℃,Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8 )
=_____________。(已知25℃,Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8 )
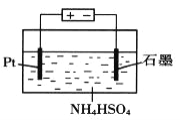
(4)当吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如图所示装置电解所得NH4HSO4溶液可制得强氧化剂(NH4)2S2O8,请写出电解NH4HSO4溶液的化学方程式_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com