
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]____________;下列状态的铝元素中,电离最外层的一个电子所需能量最小的是______________(填标号)。
A.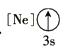 B.
B.![]() C.
C.![]() D.
D.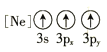
(2)8—羟基喹啉合铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与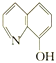 8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表格中卤化物的熔点产生差异的原因是_______________________________________________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6分子,分子中每个原子最外层均达到8电子,二聚体Al2Cl6的结构式为______________________________;其中Al的配位数为_________。
【答案】3d104s24p3 D 正四面体 O N sp2 AlF3、GaF3为离子晶体,AlCl3为分子晶体,晶格能:AlF3>GaF3, 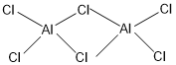 4
4
【解析】
(1) As为33号元素,原子核外电子数为33,其核外电子排布式为1s22s22p63s23p63d104s24p3;能量越高越不稳定,越易失电子,所以激发态的微粒易失电子,原子轨道中处于半满状态时较稳定;
(2)LiAlH4中的阴离子中Al原子价层电子对个数=4+![]() =4且不含孤电子对,根据价层电子对互斥理论判断其空间构型;元素的非金属性越强,电负性越大,而金属性越强,通常第一电离能最小;根据分子结构中N原子成键数和孤对电子数判断杂化方式;
=4且不含孤电子对,根据价层电子对互斥理论判断其空间构型;元素的非金属性越强,电负性越大,而金属性越强,通常第一电离能最小;根据分子结构中N原子成键数和孤对电子数判断杂化方式;
(3)通常离子晶体的熔点大于分子晶体,离子晶体的晶格能大熔点高;
②二聚体Al2Cl6中Al原子有空轨道,Cl可以提供孤电子对形成配位键;配合物中的配位数是指直接同中心离子(或原子)配位的原子数目。
(1) 基态As原子核外有33个电子,电子排布式为1s22s22p63s23p63d104s24p3,即[Ar] 3d104s24p3;A为失去两个电子后的状态, B为失去一个电子后的状态,C为失去三个电子后的状态, D为有一个电子的跃迁的激发态,A电离最外层一个电子所需能量实际就是第三电离能,B电离最外层一个电子所需能量实际就是第二电离能,C电离最外层一个电子所需能量实际就是第四电离能,D电离最外层一个电子所需能量为处于激发态的1个电子,所以需要能量最大的是C,最小的是D,故答案为D;
(2)LiAlH4中的阴离子中Al原子价层电子对个数=4+![]() =4且不含孤电子对,sp3杂化,根据价层电子对互斥理论判断其空间构型及中心原子杂化方式分别为正四面体形; 8—羟基喹啉合铝中所含元素分别是C、H、N、O和Al元素,其中氧元素的非金属性最强,则电负性最大的是O;Al是金属元素,易失电子,第一电离能较小,而非金属元素第一电离能同周期从左到右,呈增大趋势,由于N原子价电子半充满,比O原子稳定,第一电离能大于O,则N元素的第一电离能最大;分子中N原子的成键数是2和孤对电子数是1,杂化轨道数目为3,N原子采取sp2杂化;
=4且不含孤电子对,sp3杂化,根据价层电子对互斥理论判断其空间构型及中心原子杂化方式分别为正四面体形; 8—羟基喹啉合铝中所含元素分别是C、H、N、O和Al元素,其中氧元素的非金属性最强,则电负性最大的是O;Al是金属元素,易失电子,第一电离能较小,而非金属元素第一电离能同周期从左到右,呈增大趋势,由于N原子价电子半充满,比O原子稳定,第一电离能大于O,则N元素的第一电离能最大;分子中N原子的成键数是2和孤对电子数是1,杂化轨道数目为3,N原子采取sp2杂化;
(3)①表格中卤化物的熔点产生差异的原因是AlF3和GaF3是离子晶体,且晶格能AlF3>GaF3,则AlF3的熔点比GaF3高,而AlCl3是分子晶体,其熔点明显比AlF3和GaF3的熔点低;
②熔融时AlCl3生成可挥发的二聚体Al2Cl6,该二聚体由Al提供空轨道,Cl原子提供电子对形成配位键,其结构式为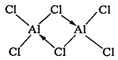 ;配合物中的配位数是指直接同中心离子(或原子)配位的原子数目,二聚体Al2Cl6中与Al直接相连的原子有4个,故其配位数为4。
;配合物中的配位数是指直接同中心离子(或原子)配位的原子数目,二聚体Al2Cl6中与Al直接相连的原子有4个,故其配位数为4。


科目:高中化学 来源: 题型:
【题目】25℃时在10 mL 0.1mol·L—1Na2CO3溶液中逐滴加入0.1 mol·L—1HCl溶液20 mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是

A.HCl溶液滴加一半时,溶液pH>7
B.当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol·L—1
C.0.1 mol·L—1Na2CO3溶液中c(Na+)+c(H+)=c(OH—)+2c(CO32—)+c(HCO3—)
D.在M点:c(Na+)>c(CO32—)=c(HCO3—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示.由图可得出的正确结论是( )
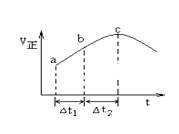
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸氢钠甲醛(xNaHSO2·yHCHO·zH2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。它的组成可通过下列实验测定:
①准确称取1.540 0 g样品,完全溶于水配成100 mL溶液;
② 取25.00 mL所配溶液经AHMT分光光度法测得甲醛物质的量浓度为0.10 mol·L-1;
③ 另取25.00 mL所配溶液,加入过量碘完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.5825g。
次硫酸氢钠甲醛和碘反应的方程式如下:xNaHSO2·yHCHO·zH2O+I2―→NaHSO4+HI+HCHO+H2O(未配平)
(1)生成0.582 5 g白色固体时,需要消耗碘的质量为________。
(2)若向吊白块溶液中加入氢氧化钠,甲醛会发生自身氧化还原反应,生成两种含氧有机物,写出该反应的离子方程式________________________________。
(3)通过计算确定次硫酸氢钠甲醛的组成(写出计算过程)。__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过___方法区分晶体、准晶体和非晶体。
(2)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是___(填字母代号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(3)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是__(填标号)。
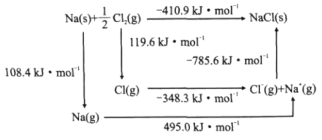
a.Cl-Cl键的键能为119.6kJ/mol b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol d.Cl的第一电子亲和能为348.3kJ/mol
(4)配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ),是铜的一种重要化合物。其中En 是乙二胺(H2N-CH2-CH2-NH2)的简写。
①该配合物中含有化学键有___(填字母编号)。
A.离子键 B.极性共价键 C.非极性共价键 D.配位键 E.金属键
②配体乙二胺分子中氮原子、碳原子轨道的杂化类型分别为___、___。
③乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是___。
④乙二胺(H2NCH2CH2NH2)是一种有机化合物,乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是___,其中与乙二胺形成的化合物稳定性相对较高的是___(填“Mg2+”或“Cu2+”)。
⑤与氨气互为等电子体的阳离子为___,与S位于同一周期,且第一电离能小于S的非金属元素符号为___。
(5)①金属钛的原子堆积方式如图1所示,则金属钛晶胞俯视图为____。

A. B.
B.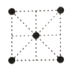 C.
C. D.
D.
②某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=__g·cm-3。
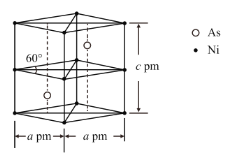
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应反应N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______移动(填“向左”“向右”或“不”);,使用催化剂_____反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______移动(填“向左”“向右”或“不”);,使用催化剂_____反应的ΔH(填“增大”“减小”或“不改变”)。
(2)O2(g)= O+2(g)+e- ![]() H1=1175.7kJ·mol-1
H1=1175.7kJ·mol-1
PtF6(g)+ e-1![]() PtF6-(g)
PtF6-(g)![]() H2= -771.1 kJ·mol-1
H2= -771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- ![]() H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的![]() H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:Zn(s) +![]() O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
Hg(l) +![]() O2(g) = HgO(s) ΔH2=-90.7kJ/mol
O2(g) = HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3,其中ΔH3的值是
A.-260.4 kJ/molB.-254.6 kJ/molC.-438.9 kJ/molD.-441.8 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com