
| A. | 氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 | |
| B. | 铵盐受热易分解 | |
| C. | 0.1mol/L的氨水可以使酚酞试液变红 | |
| D. | 0.1mol/L的NH4Cl溶液的pH约为5 |
分析 一水合氨是弱碱,说明一水合氨部分电离,溶液中存在电离平衡,根据一水合氨的电离程度划分强弱电解质,据此分析解答.
解答 解:A、氨水能跟氯化亚铁溶液反应生成氢氧化亚铁,说明氨水显碱性,不一定是弱碱,故A错误;
B、铵盐受热分解说明铵盐不稳定,与一水合氨电离程度无关,故B错误;
C、0.1mol/L的氨水可以使酚酞试液变红说明一水合氨能电离出氢氧根离子,而不能说明一水合氨的电离程度,所以不能证明一水合氨是弱电解质,故C错误;
D、0.1mol/L的氯化铵溶液的pH约为5,说明氯化铵为强酸弱碱盐,铵根离子水解而导致溶液呈酸性,则一水合氨为弱电解质,故D正确;
故选D.
点评 本题考查了电解质强弱的判断,根据电离程度划分强弱电解质,不能根据电解质溶液的导电性及电解质的溶解性强弱确定强弱电解质,为易错点.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:多选题
| A. | 此法的优点之一是原料来源丰富 | |
| B. | 进行第①②③步骤的目的是从海水中提取氯化镁 | |
| C. | 第④步处理的方法是:用CO将③得到的产物还原,得到镁 | |
| D. | 以上提取镁的过程中涉及到的反应有分解反应、化合反应和置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH固体 | B. | NaCl固体 | C. | H2O | D. | CaCO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石晶体中的最小碳原子环由6个碳原子构成 | |
| B. | 金刚石晶体中的碳原子是sp2杂化的 | |
| C. | 12g金刚石中含有C-C键的个数为4NA | |
| D. | 金刚石化学性质稳定,即使在高温下也不会和O2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
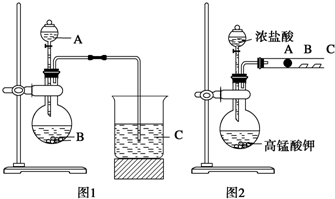
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率
乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率查看答案和解析>>
科目:高中化学 来源: 题型:选择题
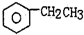 (g)$\stackrel{560℃}{?}$
(g)$\stackrel{560℃}{?}$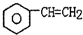 (g)+H2(g)△H<0
(g)+H2(g)△H<0| A. | 加入适当催化剂,可以提高乙苯的转化率 | |
| B. | 在保持体积一定的条件下,充入较多的乙苯,可以提高乙本的转化率 | |
| C. | 在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量不变 | |
| D. | 仅从平衡移动的角度分析,工业生产苯乙稀选择恒压条件优于恒容条件 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com