
【题目】根据研究有机化合物的步骤和方法,填满下列空格:
实验步骤 | 解释或实验结论 |
(1)测得A的蒸气密度是同状况下甲烷的4.375倍,试通过计算填空: | (1)A的相对分子质量为_______。 |
(2)将此A 5.6g在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重7.2g和17.6g | (2)A的实验式是________________。 (3)A的分子式为 _______________。 |
(3)将A通入溴水中,溴水褪色 | (4)说明A属于______________类(若溴水不褪色,则A属于 __________类) |
(4)A的核磁共振氢谱如图: | (5)综上所述,A的结构简式为 ______________。 |
【答案】70 CH2 C5H10 烯烃 环烷烃 CH2=CH-CH(CH3)2
【解析】
(1)相同条件下,气体的相对分子质量之比等于密度之比;
(2)浓硫酸增重7.2g为水的质量,碱石灰增重17.6g为二氧化碳质量,计算水、二氧化碳物质的量,进而计算n(H)、n(C),根据质量守恒确定是否含有O元素,进而确定实验式,结合相对分子质量确定分子式;
(3)将A通入溴水中,溴水褪色,A中可能含有碳碳不饱和键,结合A的分子式判断含有官能团;
(4)核磁共振氢谱中有4个吸收峰,面积之比为1:1:2:6,即有机物A中有4种H原子,数目之比为1:1:2:6,有机物A含有2个甲基,结合A的分子式书写其可能的结构。
(1)相同条件下,气体的相对分子质量之比等于密度之比,所以有机物质的相对分子质量=16×4.375=70,
故答案为:70。
(2)浓硫酸增重7.2g,则n(H2O)=7.2g÷18g/mol=0.4mol,所含有n(H)=0.8mol,碱石灰增重17.6g,则n(CO2)=17.6g÷44g/mol=0.4mol,所以n(C)=0.4mol,m(C)+m(H)=0.4mol×12g/mol+0.8mol×1g/mol=5.6g,故A不含氧元素,A分子中C、H原子数目之比=0.4:0.8=1:2,故实验式为CH2,令有机物A的分子式为(CH2)x,则14x=70,故x=5,则有机物分子式为C5H10,
故答案为:CH2;C5H10。
(3)A的分子式为C5H10,将A通入溴水中,溴水褪色,故A含有1个C=C双键,属于烯烃;若溴水不褪色,则属于环烷烃,
故答案为:烯烃;环烷烃。
(4)核磁共振氢谱中有4个吸收峰,面积之比为1:1:2:6,即有机物A中有4种H原子,数目之比为1:1:2:6,有机物A含有2个甲基,A的结构简式为:(CH3)2CHCH=CH2,
故答案为:(CH3)2CHCH=CH2。


科目:高中化学 来源: 题型:
【题目】美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁·沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享了2008年诺贝尔化学奖。经研究发现GFP中的生色基团结构如图所示,下列有关GFP的说法中正确的是( )
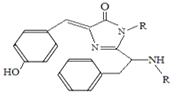
A. 该有机物属于芳香烃
B. 该有机物能发生加成反应和氧化反应
C. 1mol该有机物分子中含有7mol碳碳双键
D. 该有机物所有原子都有可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将尿酸钠(NaUr)悬浊液静置,取上层清液,再通入HCl,溶液中尿酸的浓度c(HUr)与pH 的关系如图所示。已知:Ksp(NaUr)=4.9×10-5,Ka(HUr)=2.0×10-6。下列说法正确的是
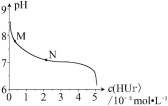
A. 上层清液中,c(Ur-) = 7.0×10-2mol·L-1
B. 在M→N 的变化过程中,c(Na+)·c(Ur-)将逐渐减小
C. 当c(HUr)= c(Ur-)时,c(Cl-)=c(Ur-)
D. 当pH=7时,2c(Na+)= c(Ur-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医院处方药“复方电解质注射液”可作为水、电解质的补充源,注射液中含有NaCl、MgCl2和KCl三种无机盐,其中![]() 。
。
(1)若实验室药配制该电解质注射液500mL,所需的玻璃仪器有:玻璃板、烧杯和_______,需用托盘天平称量氯化钠固体___________g;
(2)已知该注射液中![]() ,
,![]() ,则
,则![]() ________
________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:

则关于原溶液的判断不正确的是
A.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是制作电子集成电路的基础材料,对硅的纯度要求很高。制得高纯度硅的化学方程式为:①SiO2 + 2C ![]() Si + 2CO ②Si + 3HCl
Si + 2CO ②Si + 3HCl![]() SiHCl3 + H2 ③SiHCl3 + H2
SiHCl3 + H2 ③SiHCl3 + H2 ![]() Si + 3HCl,则有关反应分类说法正确的是
Si + 3HCl,则有关反应分类说法正确的是
A.①②③均属于氧化还原反应B.只有①属于置换反应
C.只有①属于氧化还原反应D.③属于复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A. 1mol甲基含10NA个电子
B. 标准状况下,11.2 L三氯甲烷所含的分子数目为0.5NA
C. 一定条件下,2.6 g苯和苯乙烯的混合物完全燃烧消耗O2的分子数为0.25NA
D. 15 g C2H6中含有共价键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的有机物充分燃烧后的产物通入足量的石灰水中完全吸收,经过滤得沉淀20g ,滤液质量比原石灰水减少5.8g,该有机物不可能是( )
A. 乙烯B. 乙醇C. 乙烷D. 乙二醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液Y的可能含有Na+、Fe3+、Ba2+、NH4+、Cl-、SO42-、HCO3-、HSO3-中的几种离子,溶液中阳离子浓度相同。为了确定其组成,某同学进行了如下实验(假设气体均全部逸出,忽略H2O2的分解)下列说法不正确的是
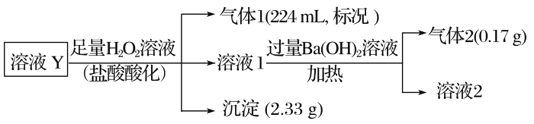
A.溶液Y中一定不存在Fe3+、SO42-
B.溶液Y中一定含有Cl-,且n(Cl-)=001mol
C.沉淀中肯定只含有BaSO4
D.溶液Y中可能存在Na+,为确定是否存在,可取溶液1通过焰色反应实验验证
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com