
【题目】某无色溶液Y的可能含有Na+、Fe3+、Ba2+、NH4+、Cl-、SO42-、HCO3-、HSO3-中的几种离子,溶液中阳离子浓度相同。为了确定其组成,某同学进行了如下实验(假设气体均全部逸出,忽略H2O2的分解)下列说法不正确的是
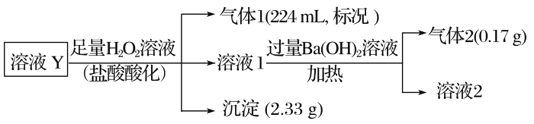
A.溶液Y中一定不存在Fe3+、SO42-
B.溶液Y中一定含有Cl-,且n(Cl-)=001mol
C.沉淀中肯定只含有BaSO4
D.溶液Y中可能存在Na+,为确定是否存在,可取溶液1通过焰色反应实验验证
【答案】B
【解析】
由实验可知,加足量的H2O2,可氧化HSO3-为SO42-,酸化得到的气体1为二氧化碳,则一定含n(HCO3-)=![]() =0.01mol,沉淀2.33g为BaSO4,则原溶液中一定含Ba2+和HSO3-,n(BaSO4)=
=0.01mol,沉淀2.33g为BaSO4,则原溶液中一定含Ba2+和HSO3-,n(BaSO4)=![]() =0.01mol,Ba2+和HSO3-的物质的量至少为0.01mol。原溶液中含Ba2+,则一定不含SO42-。由溶液无色可知一定不含Fe3+;溶液1中加过量氢氧化钡、加热生成的气体2为氨气,则原溶液一定含n(NH4+)=
=0.01mol,Ba2+和HSO3-的物质的量至少为0.01mol。原溶液中含Ba2+,则一定不含SO42-。由溶液无色可知一定不含Fe3+;溶液1中加过量氢氧化钡、加热生成的气体2为氨气,则原溶液一定含n(NH4+)=![]() =0.01mol,没有沉淀生成说明没有SO42-,即在原溶液中HSO3-的物质的量为0.01mol,则Ba2+的物质的量至少为0.01mol。根据电荷守恒,原溶液中一定存在Cl-,其物质的量至少为0.01×2+0.01-0.01-0.01=0.01mol。由上述分析可知,原溶液中一定含Ba2+、NH4+、HCO3、HSO3、Cl-,物质的量分别为:至少0.01mol、0.01mol、0.01mol、0.01mol、至少0.01mol。一定不含Fe3+、SO42,不能确定原溶液中是否含Na+。
=0.01mol,没有沉淀生成说明没有SO42-,即在原溶液中HSO3-的物质的量为0.01mol,则Ba2+的物质的量至少为0.01mol。根据电荷守恒,原溶液中一定存在Cl-,其物质的量至少为0.01×2+0.01-0.01-0.01=0.01mol。由上述分析可知,原溶液中一定含Ba2+、NH4+、HCO3、HSO3、Cl-,物质的量分别为:至少0.01mol、0.01mol、0.01mol、0.01mol、至少0.01mol。一定不含Fe3+、SO42,不能确定原溶液中是否含Na+。
A. 根据以上分析,溶液Y 中一定不存在Fe3+、SO42-,故A正确;
B. 根据以上分析,溶液Y中一定含有Cl-,且n(Cl-)≥001mol,故B错误;
C. 根据上述分析,沉淀中肯定只含有BaSO4,故C正确;
D. Na+焰色反应呈黄色,溶液A中可能存在Na+,为了确定是否存在,可取溶液通过焰色反应验证,故D正确;
答案为B。


科目:高中化学 来源: 题型:
【题目】根据研究有机化合物的步骤和方法,填满下列空格:
实验步骤 | 解释或实验结论 |
(1)测得A的蒸气密度是同状况下甲烷的4.375倍,试通过计算填空: | (1)A的相对分子质量为_______。 |
(2)将此A 5.6g在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重7.2g和17.6g | (2)A的实验式是________________。 (3)A的分子式为 _______________。 |
(3)将A通入溴水中,溴水褪色 | (4)说明A属于______________类(若溴水不褪色,则A属于 __________类) |
(4)A的核磁共振氢谱如图: | (5)综上所述,A的结构简式为 ______________。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I 将0.1 mol的镁、铝混合物溶于100mL 2mol·L-1的H2SO4溶液中,然后再滴加1mol·L-1的NaOH溶液。请回答:(不需要写出计算过程)
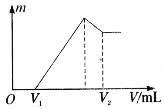
(1)若在滴加NaOH溶液的过程中沉淀质量![]() 随加入NaOH溶液的体积V变化如图所示。当
随加入NaOH溶液的体积V变化如图所示。当![]() mL时,则金属粉末中n(Mg)=________mol,
mL时,则金属粉末中n(Mg)=________mol,![]() _______mL。
_______mL。
(2)①要配制100 mL 2mol·L![]() 的H2SO4溶液,需要的仪器除量筒、烧杯外,还有______________
的H2SO4溶液,需要的仪器除量筒、烧杯外,还有______________
②下列操作会使所配的溶液浓度偏小的是___________(填代号)
A.用量筒量取一定体积的98%的浓H2SO4,稀释后未经冷却即转入容量瓶内
B.稀释硫酸所用的小烧杯未洗涤
C.定容时俯视液面
D.用蒸馏水洗涤后的容量瓶未干燥
E.定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液浅出瓶外
II(1)在100 g物质的量浓度为cmol/l,密度为pg/ mL的硫酸中加入一定量的水稀释成0.5cmol/L的硫酸,则加入水的体积________100 mL (填 “== ”“< ” “ >” 下同)
(2)若把(1)中的硫酸改成氨水,应加入水的体积______100 mL
(3)若把(1)、(2)中物质的量的浓度均改为溶质的质量分数,则加入水的体积_____100 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的数目是
①12.0g熔融的NaHSO4中含有的阳离子数为0.2NA
②1mol Na2O 和Na2O2混合物中含有的阴、阴离子总数是3NA
③常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
④7.8g![]() 中含有的碳碳双键数目为0.3NA
中含有的碳碳双键数目为0.3NA
⑤用1L1.0 mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为NA
⑥1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2NA个电子
⑦在反应KIO3+6HI=KI+3I2 +3H2O 中,每生成3molI2转移的电子数为5NA
⑧常温常压下,17 g甲基(-14CH3)中所含的中子数为9NA
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是______mol。
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是________,又变为棕黄色的原因是用离子方程式解释___________________________.
(3)在100mLFeBr2溶液中通入标况下2.24LCl2,溶液溶液中有1/4的Br- 被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_________________。
(4)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式_________。向反应后的溶液中通入过量CO2,反应的离子方程式为______。
(5)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式___________,反应中生成0.2mol HNO3,转移的电子数目为_______。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室模拟工业生产漂白粉的装置(夹持和加热装置省略)。
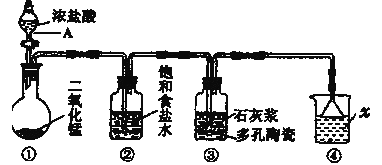
(1)写出图中仪器A的名称___;②装置中饱和食盐水的作用是___。
(2)装置①中发生反应的化学方程式为___。
(3)装置③中发生反应的化学方程式为___。
(4)装置④中发生反应的离子化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油化工产品1,3-丁二烯合成化工中间物 ![]() 的合成路线如下:
的合成路线如下:

已知:![]() 。
。
(1)A的系统命名为____________________。
(2)![]() 含有的官能团为______________________________。
含有的官能团为______________________________。
(3)写出③⑥的反应类型分别为__________、__________。
(4)反应④的化学方程式为_____________________________________________。
(5)![]() 的同分异构体中,满足以下条件的有__________种,其中核磁共振氢谱显示有5组峰的结构简式为____________________。
的同分异构体中,满足以下条件的有__________种,其中核磁共振氢谱显示有5组峰的结构简式为____________________。
①能与FeCl3溶液发生显色反应;②能发生银镜反应。
(6)请设计合理方案用![]() 合成
合成![]() (其他原料自选,用反应流程图表示,并注明必要的反应条件)____________________。
(其他原料自选,用反应流程图表示,并注明必要的反应条件)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KNO3固体样品中含有少量的KCl、BaCl2杂质,为了提纯KNO3并分离得到BaCl2,进行如下实验操作:
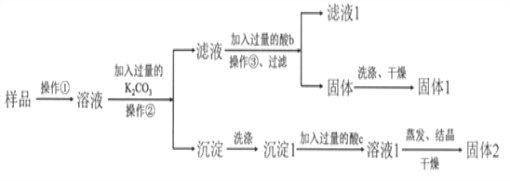
(1)试剂c的化学式是__________,固体1的化学式是__________。加入过量K2CO3所发生反应的化学方程式为________________________________。
(2)结合下图各物质的溶解度曲线可知操作③的名称是_______、________。
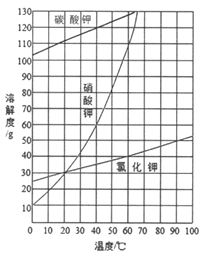
(3)有同学认为操作③之前无需加入过量的酸b,也能得到纯净的固体1,你认为该同学的观点是否正确?_____;并做出相应解释___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国康乃尔大学的威考克斯(C·Wilcox)所合成的一种有机分子就像一尊释迦牟尼佛像,因而称为释迦牟尼分子(分子中所有原子均在同一平面)如图。对于该有机物的叙述正确的是
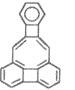
①该有机物属于芳香烃;②该有机物的分子式为C22H12; ③该有机物能发生加成反应;④该有机物的一氯代物的同分异构体有6种
A. ①③④B. ①②C. ②③D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com