
【题目】如图是实验室模拟工业生产漂白粉的装置(夹持和加热装置省略)。
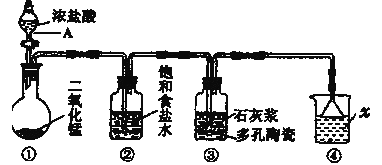
(1)写出图中仪器A的名称___;②装置中饱和食盐水的作用是___。
(2)装置①中发生反应的化学方程式为___。
(3)装置③中发生反应的化学方程式为___。
(4)装置④中发生反应的离子化学方程式为___。
【答案】分液漏斗 除去氯气中的氯化氢气体 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Cl2+2OH-= Cl-+ClO-+H2O
MnCl2+Cl2↑+2H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Cl2+2OH-= Cl-+ClO-+H2O
【解析】
利用浓盐酸和二氧化锰加热条件下反应制取氯气,发生的反应为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;由于浓盐酸具有挥发性,制取的氯气中含有氯化氢,通过②装置中的饱和食盐水除去氯化氢气体,净化后的氯气通入装置③中与石灰浆发生反应生成次氯酸钙,化学反应为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;氯气有毒,不能排放到大气中,未反应的氯气需要氢氧化钠溶液吸收处理,发生的反应为Cl2+2OH-= Cl-+ClO-+H2O;
MnCl2+Cl2↑+2H2O;由于浓盐酸具有挥发性,制取的氯气中含有氯化氢,通过②装置中的饱和食盐水除去氯化氢气体,净化后的氯气通入装置③中与石灰浆发生反应生成次氯酸钙,化学反应为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;氯气有毒,不能排放到大气中,未反应的氯气需要氢氧化钠溶液吸收处理,发生的反应为Cl2+2OH-= Cl-+ClO-+H2O;
(1)图中仪器A的名称为分液漏斗;②装置中饱和食盐水的作用是除去氯气中的氯化氢气体,
答案为:分液漏斗;除去氯气中的氯化氢气体;
(2)根据上述分析,装置①中发生反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)根据上述分析,装置③中发生反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)根据分析,装置④中发生反应的离子化学方程式为Cl2+2OH-= Cl-+ClO-+H2O,
答案为:Cl2+2OH-= Cl-+ClO-+H2O。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】单晶硅是制作电子集成电路的基础材料,对硅的纯度要求很高。制得高纯度硅的化学方程式为:①SiO2 + 2C ![]() Si + 2CO ②Si + 3HCl
Si + 2CO ②Si + 3HCl![]() SiHCl3 + H2 ③SiHCl3 + H2
SiHCl3 + H2 ③SiHCl3 + H2 ![]() Si + 3HCl,则有关反应分类说法正确的是
Si + 3HCl,则有关反应分类说法正确的是
A.①②③均属于氧化还原反应B.只有①属于置换反应
C.只有①属于氧化还原反应D.③属于复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属,且C的合金用量最大。三种金属单质A、B、C与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。

请根据以上信息回答下列问题:
(1)画出A的原子结构示意图:_______________________________________,
(2)写出下列物质的化学式: H:__________、乙:________________,
(3)C的一种氧化物是具有磁性的黑色晶体,该氧化物的化学式是_____________。
(4)写出反应①的离子方程式:反应①______________________________;
(5)写出反应②的化学方程式:反应②___________________________________;
(6)检验溶液E中阴离子的常用方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为_____________________________,Cu位于元素周期表第ⅠB族。Cu 2+的核外电子排布式为____________________。
(2)胆矾CuSO4·5H2O可写成[Cu(H2O) 4 ]SO4 ·H2O,其结构示意图如下:
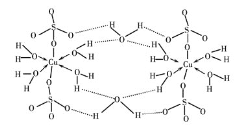
下列说法正确的是________(填字母)。
A.水中的氧原子采用sp3 杂化
B.氧原子参与形成配位键和氢键两种化学键
C.Cu2+的价电子排布式为3d84s1
D.胆矾中的水在不同温度下会分步失去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液Y的可能含有Na+、Fe3+、Ba2+、NH4+、Cl-、SO42-、HCO3-、HSO3-中的几种离子,溶液中阳离子浓度相同。为了确定其组成,某同学进行了如下实验(假设气体均全部逸出,忽略H2O2的分解)下列说法不正确的是
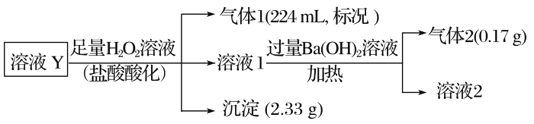
A.溶液Y中一定不存在Fe3+、SO42-
B.溶液Y中一定含有Cl-,且n(Cl-)=001mol
C.沉淀中肯定只含有BaSO4
D.溶液Y中可能存在Na+,为确定是否存在,可取溶液1通过焰色反应实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠和碳酸氢钠都是中学常见化学药品。
Ⅰ.下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的装置:
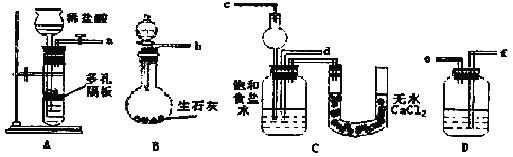
请回答下列问题(提示B分液漏斗中为浓氨水,滴入烧瓶可产生氨气):
(1)装置的连接顺序是:a接___,___接___;b接___。
(2)检查装置气密性后,必须先让___(填A或B)装置先发生反应。C中用球形干燥管而不用直导管,其作用是___。
(3)C中广口瓶内产生固体的总化学方程式为___。
Ⅱ.通过加热分解的方法可以测定碳酸钠和碳酸氢钠的含量。取13.08g碳酸钠和碳酸氢钠的混合物充分加热,将生成的CO2气体通入足量的澄清石灰水中,测得生成沉淀的质量为4.0g。
(4)加热时发生的化学反应方程式为___。
(5)原混合物中碳酸钠和碳酸氢钠的物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molM和2 molN置于体积为2L的恒容密闭容器中,发生反应:M(s)+2N(g)![]() P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )

A. 若X、Y两点的平衡常数分别为K1、K2,则K1>K2
B. 温度为T1时,N的平衡转化率为80%,平衡常数K=40
C. 无论温度为T1还是T2,当容器中气体密度和压强不变时,反应达平衡状态
D. 降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 氧化还原反应一定属于四大基本反应类型
B. 氧化还原反应中,反应物不是氧化剂就是还原剂
C. 在氧化还原反应中,氧化剂和还原剂既可以是不同物质也可以是同种物质
D. 失电子越多,还原性越强,得电子越多,氧化性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题:
(1)标准状况下,2.24L Cl2的质量为__________g。
(2)10.8g R2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为__________。
(3)阻燃剂碱式碳酸铝镁中OH-与CO32-质量之比为51:300,则这两种离子的物质的量之比为____________。
(4)将10mL 1.00mol/L Na2CO3溶液与10mL 1.00mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为______________mol/L(忽略混合前后溶液体积的变化)。
(5)3.5mol Ba(OH)2中约含有____________个OH-。
(6)100g质量分数为46%的酒精(CH3CH2OH)溶液中氧原子的物质的量为___________。
(7)把 200mL NH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含a mol NaOH的溶液恰好反应完全;取另一份加入含b mol HCl的盐酸恰好反应完全.该混合溶液中c(Na+)为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com