
【题目】铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为_____________________________,Cu位于元素周期表第ⅠB族。Cu 2+的核外电子排布式为____________________。
(2)胆矾CuSO4·5H2O可写成[Cu(H2O) 4 ]SO4 ·H2O,其结构示意图如下:
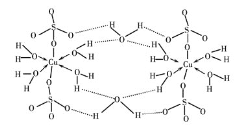
下列说法正确的是________(填字母)。
A.水中的氧原子采用sp3 杂化
B.氧原子参与形成配位键和氢键两种化学键
C.Cu2+的价电子排布式为3d84s1
D.胆矾中的水在不同温度下会分步失去
【答案】 [Ar]3d9 AD
[Ar]3d9 AD
【解析】
(1)[Cu(OH)4]2-配合物中,铜原子提供空轨道,OH-中氧原子提供孤电子对,Cu2+与4个OH-形成配位键,配位键由提供孤电子对的原子指向提供空轨道的原子,所以其表示方法为: ;
;
Cu(电子排布式为:[Ar]3d104s1)Cu2+的过程中,参与反应的电子是最外层的4s及3d上各一个电子,故Cu2+离子的电子是为:[Ar]3d9或1s22s22p63s23p63d9;
(2)A.水中O原子为sp3杂化,硫酸根离子中羟基氧是sp3杂化,非羟基氧不是中心原子原子,不参与杂化杂化,选项A正确;
B.在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键,配离子与硫酸根之间形成离子键,选项B错误;
C.Cu2+的价电子排布式为[Ar]3d9或1s22s22p63s23p63d9,选项C错误;
D.由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结构上有着不同,胆矾中的水在不同温度下会分步失去,选项D正确。
答案选AD。


科目:高中化学 来源: 题型:
【题目】锂离子电池应用很广。某种锂离子二次电池的电极材料主要是钴酸锂(LiCoO2)和石墨。钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大。
(1)锂离子电池(又称锂离子浓差电池)的工作原理:
ⅰ.充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,此时该极处于贫锂态(Li1-xCoO2)。
ⅱ.放电过程原理示意图如图所示:
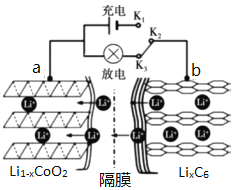
①放电时,电流从______(填“a”或“b”)极流出。
②充电时,a极的电极反应式为______。
(2)钴酸锂回收再生流程如下:
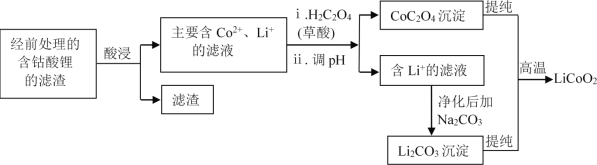
①用H2SO4酸浸时,通常添加30%的H2O2以提高浸出效率,其中H2O2的作用是______。
②用盐酸代替H2SO4和H2O2,浸出效率也很高,但工业上不使用盐酸,主要原因之一是:会产生有毒、有污染的气体。写出相应反应的化学方程式_______。
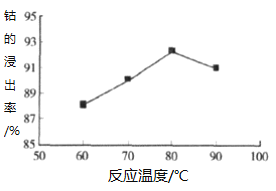
③其他条件不变时,相同反应时间,随着温度升高,含钴酸锂的固体滤渣在H2SO4和30% H2O2 混合液中的浸出率曲线如图,请解释温度高于80℃,钴的浸出率变化的原因:______。
④高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有机物A样品3.0g,对其进行如下操作:充分燃烧得3.36 L CO2(标准状况)和3.6 g H2O;质谱分析得A的相对分子质量为60,A的分子式为____________。A在催化剂Cu的作用下能被氧气氧化成C,C不能发生银镜反应,则A的名称是____________,C中官能团名称为____________。
(2)![]() 的同分异构体中,既能发生银镜反应,又能与FeCl3溶液发生显色反应的共有________种,其中核磁共振氢谱为5组峰,且峰面积比为2∶2∶2∶1∶1的为_____________ (写结构简式)。
的同分异构体中,既能发生银镜反应,又能与FeCl3溶液发生显色反应的共有________种,其中核磁共振氢谱为5组峰,且峰面积比为2∶2∶2∶1∶1的为_____________ (写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8g该有机物经燃烧生成44.0gCO2和14.4gH2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子端的—C≡C—键,核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1。
(1)A的分子式是____________________________________。
(2)下列物质中,一定条件下能与A发生反应的是________。
A.H2 B.Na C.酸性KMnO4溶液 D.Br2
(3)A的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的数目是
①12.0g熔融的NaHSO4中含有的阳离子数为0.2NA
②1mol Na2O 和Na2O2混合物中含有的阴、阴离子总数是3NA
③常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
④7.8g![]() 中含有的碳碳双键数目为0.3NA
中含有的碳碳双键数目为0.3NA
⑤用1L1.0 mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为NA
⑥1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2NA个电子
⑦在反应KIO3+6HI=KI+3I2 +3H2O 中,每生成3molI2转移的电子数为5NA
⑧常温常压下,17 g甲基(-14CH3)中所含的中子数为9NA
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2·12H2O俗称铵明矾,其性质稳定,是化学实验常用的基准试剂。用碳酸氢铵与硫酸钠可以制备纯净的铵明矾,制备过程如图,下面说法不正确的是
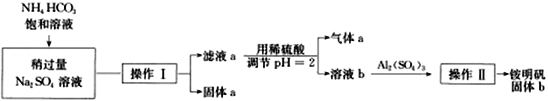
A.加入NH4HCO3饱和溶液发生反应的离子方程式:Na++HCO3-=NaHCO3↓
B.调节pH时,为了减少损耗,提高产率,可将pH试纸直接浸入滤液a中
C.操作Ⅱ的基本过程为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.若过量的气体a通入到饱和的纯碱溶液中会有晶体析出,该晶体与固体a相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室模拟工业生产漂白粉的装置(夹持和加热装置省略)。
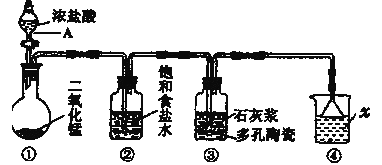
(1)写出图中仪器A的名称___;②装置中饱和食盐水的作用是___。
(2)装置①中发生反应的化学方程式为___。
(3)装置③中发生反应的化学方程式为___。
(4)装置④中发生反应的离子化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)俗称“工业盐”,其外观与食盐相似,有咸味,有毒,可用做食品防腐剂和肉类食品的发色剂。已知亚硝酸钠能与氢碘酸(HI,具有强酸性)发生如下反应:4HI+2NaNO2=2NaI+I2+2NO↑+2H2O。下列说法正确的是
A. 亚硝酸钠具有氧化性,不可能表现出还原性
B. 该反应中氧化剂与还原剂的物质的量之比为1:1
C. 向反应所得的混合溶液中加入稀硫酸和亚硝酸钠,I-不可能转化为I2
D. 人误食亚硝酸钠中毒时,可服用氢碘酸解毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知:
![]()
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |

(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层(填上或下),分液后用____________(填入字母编号)洗涤。
a KMnO4溶液 b 稀H2SO4 c Na2CO3溶液
②再通过____________(填操作名称)即可得到精品。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com