
【题目】一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3)的原理如下图:

(1)二甲醚的合成反应:3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g) ΔH1
CH3OCH3(g)+CO2(g) ΔH1
①已知CO、H2与CH3OCH的燃烧热(ΔH)分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1、(a、b、c均小于0),则ΔH1=________kJ·mol-1。
②该反应选用CuO/ZnO/Al2O3复合催化剂,该催化剂能_______(填标号)。
A.促进平衡正向移动 B.提高反应速率
C.降低反应的活化能 D.改变反应的焓变
(2)CH4氧化器中发生的主反应:
ⅰ. CH4(g)+Fe3O4(s)![]() CO(g)+2H2(g)+3Fe(s)
CO(g)+2H2(g)+3Fe(s)
ⅱ. CH4(g)+4Fe3O4(s)![]() CO2(g)+2H2O(g)+12FeO(s)
CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如下图。

①随着压强的增大,反应ⅰ的平衡常数K值________(填“增大”、“减小”、 或“不变”)
②结合图像,分析H2O的体积分数变化的原因_________(用化学方程式表示)
(3)将一定量的FeO和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:
CO2(g)+3FeO(s)![]() Fe3O4(s)+ CO (g) ΔH2
Fe3O4(s)+ CO (g) ΔH2
保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如下表:
温度I/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
①ΔH2_______0(填“>”或“<”)。
②若在150℃时进行上述转化,理论转化率ɑ(FeO)=___________。
③在上述反应体系中,一定可以说明该反应达到平衡状态的是______(填标号)。
A.体系的压强不变 B.CO2的物质的量不变
C.CO的生成速率和消耗速率相等且不等于零 D.气体的平均摩尔质量不变
④根据化学反应原理,分析CO2还原器温度设置在170℃的原因___________。
【答案】 (3a+3b-c) BC 不变 Fe3O4+H2![]() 3FeO+H2O < 100% C 温度过高,CO2的转化率低;温度过低,反应速率比较慢
3FeO+H2O < 100% C 温度过高,CO2的转化率低;温度过低,反应速率比较慢
【解析】(1)二甲醚的合成反应:3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g) ΔH1
CH3OCH3(g)+CO2(g) ΔH1
①已知:②CO(g)+ ![]() O2(g)=CO2(g) ΔH2=a kJ·mol-1,③H2(g)+
O2(g)=CO2(g) ΔH2=a kJ·mol-1,③H2(g)+ ![]() O2(g)=H2O(l) ΔH3=b kJ·mol-1, ④CH3OCH3(g)+3O2(g)=3H2O(l) +2CO2(g) ΔH4=c kJ·mol-1,根据盖斯定律可知,②×3+③×3-④可得3CO(g)+3H2(g)
O2(g)=H2O(l) ΔH3=b kJ·mol-1, ④CH3OCH3(g)+3O2(g)=3H2O(l) +2CO2(g) ΔH4=c kJ·mol-1,根据盖斯定律可知,②×3+③×3-④可得3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g) ,则ΔH1=(3a+3b-c)kJ·mol-1;
CH3OCH3(g)+CO2(g) ,则ΔH1=(3a+3b-c)kJ·mol-1;
②催化剂能降低反应所需要的活化能,不影响焓变,同等程度加快正逆反应速率,平衡不移动,故答案为BC;
(2)①反应方程式的系数确定后,平衡常数只与温度有关,温度不变,平衡常数不变,故改变压强,K值不变;
②结合图像可以看出H2O的体积分数变大的同时H2的体积分数在减小,所以发生的反应是Fe3O4+H2![]() 3FeO+H2O ;
3FeO+H2O ;
(3)①根据表中数据可以看出,随着温度的升高,CO2的体积分数变大,CO的体积分数变小,说明平衡逆向移动,而温度升高,平衡朝吸热方向移动,说明逆向是吸热的,那么正向是放热的,即ΔH2<0;
②由图表可以看出温度从100℃上升到170℃,CO2和CO的体积分数都没变,说明这个区域内虽然温度变化,但是平衡没有移动,理论上已经全部转化了,所以理论值是100%;
③反应CO2(g)+3FeO(s)![]() Fe3O4(s)+ CO (g)是前后体积不变的反应,所以压强不变不能判断是否达到平衡,A错误;由第②问可以看出温度从100℃上升到170℃,已经完全转化了,此时CO2和CO的体积分数都没变,但是此时不算平衡状态,所以B和D错误;只有C是根据化学平衡的定义描述的,即平衡时正逆反应速率相等且不0,故C正确,答案为C。
Fe3O4(s)+ CO (g)是前后体积不变的反应,所以压强不变不能判断是否达到平衡,A错误;由第②问可以看出温度从100℃上升到170℃,已经完全转化了,此时CO2和CO的体积分数都没变,但是此时不算平衡状态,所以B和D错误;只有C是根据化学平衡的定义描述的,即平衡时正逆反应速率相等且不0,故C正确,答案为C。
④温度选择170℃从平衡的角度分析,是因为温度过高,CO2的转化率会变低,而从速率的角度分析,温度过低又会使反应速率变慢,则应选择一个合适的温度。


科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,下列说法中正确的是
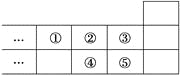
A. 元素①位于第2周期第ⅣA族
B. 气态氢化物的稳定性:④>②
C. 最高价氧化物对应水化物的酸性:⑤>④
D. 元素的最高正化合价:③=⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,既有共价键和离子键断裂,又有共价键和离子键形成的是( )
A.2Na+2H2O=2NaOH+H2↑
B.2Na2O2+2CO2=2Na2CO3+O2
C.Cl2+H2OHCl+HC1O
D.Na2CO3+BaCl2=BaCO3↓+2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡 向________(填“正”或“逆”)反应方向移动;溶液中![]() 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5 mol·L-1;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,KW=1.0×10-12 mol2·L-2,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为________________。
②该温度下,将0.01 mol·L-1H2A溶液稀释到20倍后,溶液的pH=__________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气____________。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.0500 mol·L-1H2C2O4(二元弱酸)溶液滴定 25.00 mL 0.100 0 mol L-1NaOH溶液所得滴定曲线如右图。下列说法正确的是( )

A. 点①所示溶液中:c(H+)+c(H2C2O4)+ c(HC2O4-)=c(OH-)
B. 点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C. 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 滴定过程中可能出现:c(Na+) > c(C2O42-) =c(HC2O4-)>C(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两位同学,他们一起做了如图所示的水果电池实验,测得数据如下表:
实验次数 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
1 | 锌 | 铜 | 菠萝 | 3 | 900 |
2 | 锌 | 铜 | 苹果 | 3 | 650 |
3 | 锌 | 铜 | 柑橘 | 3 | 850 |
4 | 锌 | 铜 | 西红柿 | 3 | 750 |
5 | 锌 | 铝 | 菠萝 | 3 | 650 |
6 | 锌 | 铝 | 苹果 | 3 | 450 |
甲同学提出的问题,乙同学解释不正确的是
①甲:实验6中的负极反应如何写? 乙:铝为负极:Al-3e-===Al3+
②甲:实验1、5电流方向为什么相反? 乙:实验1中锌为负极,电流由铜经导线流向锌;实验5中铝为负极,铝失去电子,电流由锌经导线流向铝
③甲:水果电池的电压与哪些因素有关? 乙:只跟水果的品种有关。
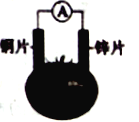
A. ③ B. ① C. ①②③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在25 mL 0.1 mol·L-1的NaOH溶液中逐渐加入0.2 mol·L-1 CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )
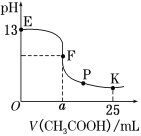
A.a=12.5,且混合溶液pH=7
B.对应曲线上E、F之间的任何一点,溶液中都有 c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在透明溶液中,不能大量共存的离子组是( )AC
A.Cu2+、Na+、SO42-、Cl- B.K+、Na+、HCO3-、NO3-
C.OH-、HCO3-、Ca2+、Na+ D.Ba2+、Na+、OH-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com