
| A. | NaOH+HCl═NaCl+H2O | B. | MnO2+4HCl(浓)═MnCl2+2H2O+Cl2↑ | ||
| C. | Fe+2HCl═FeCl2+H2↑ | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
分析 反应中,HCl 既体现酸性又体现还原性,说明该反应中有电子转移,且HCl部分化合价不变、部分化合价降低,据此分析解答.
解答 解:A.该反应中各元素化合价不变,不属于氧化还原反应,属于复分解反应,故A错误;
B.该反应中部分Cl元素化合价不变、部分Cl元素化合价由-1价变为0价,所以HCl 既体现酸性又体现还原性,故B正确;
C.该反应中HCl中H元素化合价由+1价变为0价,所以HCl作氧化剂,故C错误;
D.该反应中各元素化合价不变,所以不是氧化还原反应,故D错误;
故选B.
点评 本题考查了氧化还原反应,根据元素化合价变化结合基本概念分析判断,了解常见元素化合价,题目难度不大.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2,100 mL | B. | O2,200 mL | C. | N2,400 mL | D. | CH4,600 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
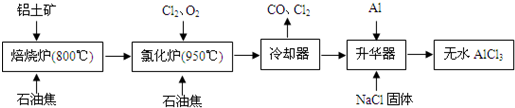
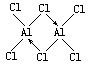 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K能从LiCl的溶液中置换出Li | |
| B. | 随着原子序数的递增,单质与水反应的剧烈程度减弱 | |
| C. | 随着原子序数的递增,单质熔点逐渐降低 | |
| D. | Cs2CO3受热易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,0.2molFe与足量稀硫酸反应反应,生成的H2分子数目为0.3NA | |
| B. | 2 L0.5 mol×L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | C2H4和N2组成的42g混合气体中原子的个数为3NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28gN2 时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{n}$mol-1 | B. | 9n mol-1 | C. | 2n mol-1 | D. | n mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X是第IA元素,Z是第ⅦA元素 | |
| B. | 元素X、Z形成的化合物是共价化合物 | |
| C. | Y一定是金属元素 | |
| D. | Z的最高价氧化物对应的水化物是弱酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com