
 H2SO4的物质的量之比为 ( )
H2SO4的物质的量之比为 ( )
| A.1 :7 | B.7 :1 | C.7 :8 | D.8 :7 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
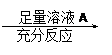 为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案:
为了测定一定质量的铜铝混合物中铜的质量分数,某化学课外活动小组设计了如下两个方案: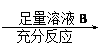 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
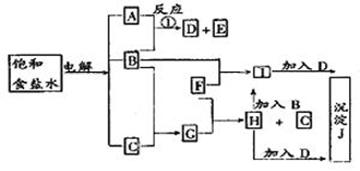
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol·L-1硫酸、2mol·L-2硝酸、2mol·NaOH溶液、20%KSCN溶液。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol·L-1硫酸、2mol·L-2硝酸、2mol·NaOH溶液、20%KSCN溶液。 完成以下实验探究过程:
完成以下实验探究过程: (1)提出假设:
(1)提出假设: 假设1:该混合金属粉末中除铝外还含有 元素;
假设1:该混合金属粉末中除铝外还含有 元素; 假设2:该混合金属粉末中除铝外还含有 元素;
假设2:该混合金属粉末中除铝外还含有 元素; 假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素; (2)设计实验方案基于假设3,设计出实验方案(不要在答题卡上作答)。
(2)设计实验方案基于假设3,设计出实验方案(不要在答题卡上作答)。 (3)实验过程
(3)实验过程 根据(2)的实验方案,叙述实验操作、预期现象和结论。
根据(2)的实验方案,叙述实验操作、预期现象和结论。 【提示】Ⅰ.在答题卡上按以下方式作答,注意前后内容对应;
【提示】Ⅰ.在答题卡上按以下方式作答,注意前后内容对应; Ⅱ.注意文字简洁,确保不超过答题卡空间。
Ⅱ.注意文字简洁,确保不超过答题卡空间。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.Cu2+和Ag+相似,能与NH3结合生成铜氨络离子 | B.白色沉淀为+2价铜的某种亚硫酸盐,溶于H2SO4发生复分解反应 | C.白色沉淀为+1价铜的某种亚硫酸盐,在酸性条件下,只发生了氧化反应 | D.反应过程中消耗的SO2与生成的SO2的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
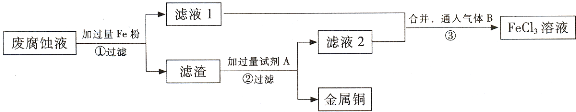
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com