
【题目】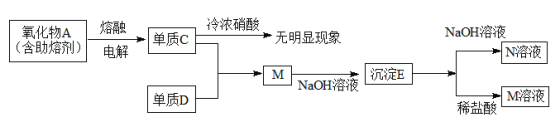
(1)M的化学式是AlCl3,用离子方程式表示其水溶液的酸碱性情况______________。
(2)元素C在周期表中的位置是第三周期第ⅢA族,其最高价氧化物对应的水化物的电离方程式是____________________。
(3)写出E与NaOH溶液反应的离子方程式________________________。
(4)单质C遇冷浓硝酸无明显现象的原因是______________________。
(5)电解熔融态氧化物A时,阳极发生的电极反应是___________________;没有发现熔剂之前,由于氧化物A熔点高,难以实现工业化过程,从物质结构角度说明A具有高熔点的原因_____________________。
【答案】Al3++3H2O![]() Al(OH)3+3H+ H++AlO2-+H2O
Al(OH)3+3H+ H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH- Al(OH)3+OH-=AlO2-+2H2O 铝遇冷浓硝酸钝化,在铝表面生成致密氧化膜,阻止反应继续发生 2O2--4e-=O2↑ Al2O3是离子晶体,Al3+、O2-电荷高,半径小,离子键强,熔点高
Al3++3OH- Al(OH)3+OH-=AlO2-+2H2O 铝遇冷浓硝酸钝化,在铝表面生成致密氧化膜,阻止反应继续发生 2O2--4e-=O2↑ Al2O3是离子晶体,Al3+、O2-电荷高,半径小,离子键强,熔点高
【解析】
单质C中含有的元素位置是第三周期第ⅢA族,则C为Al,所以氧化物A为Al2O3,电解熔融的Al2O3制取得到金属Al和O2,则单质C为Al,Al在室温下遇浓硝酸会发生钝化现象;M是AlCl3,则单质D为Cl2,向AlCl3溶液中加入少量NaOH溶液,反应产生Al(OH)3沉淀,则E为Al(OH)3,Al(OH)3显两性,与强碱NaOH溶液反应产生N为NaAlO2,与盐酸反应产生M为AlCl3,然后分析解答。
根据上述分析可知A是Al2O3,C是Al,D是Cl2,E为Al(OH)3,M为AlCl3,N为NaAlO2。
(1) AlCl3是强酸弱碱盐,在溶液中Al3+会发生水解作用,消耗水电离产生的OH-,促进水的电离平衡正向移动,最终达到平衡时,溶液中c(H+)>c(OH-),因此溶液显酸性,水解的离子方程式为:Al3++3H2O![]() Al(OH)3+3H+;
Al(OH)3+3H+;
(2)Al(OH)3是两性氢氧化物,既能与强酸反应产生盐和水,也能与强碱反应产生盐和水,这是由于其在水溶液中存在两性电离作用:H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-;
Al3++3OH-;
(3)Al(OH)3与NaOH溶液反应产生NaAlO2和水,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
(4)浓硝酸具有强的氧化性,在室温下Al遇浓硝酸,在金属Al表面会产生一层致密的氧化物薄膜,阻止金属的进一步反应,即发生钝化现象;
(5)电解熔融态氧化物Al2O3时,阳极上,O2-失去电子变为O2,发生氧化反应,阳极的电极反应是2O2--4e-=O2↑;Al2O3是离子化合物,熔点很高,Al3+、O2-离子半径小,有较高的电荷,离子键很强,断裂消耗很高的能量,因此具有较高的熔点,其熔点高达2050℃,所以中没有发现熔剂之前,难以实现工业化过程。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】工业排放物可能对环境和人体健康产生危害,必须经过处理才可排放。根据题意回答下列问题。
Ⅰ.处理含SO2、NO的烟气
在323 K温度下,向盛有NaClO2溶液的鼓泡反应器中通入含有SO2和NO的烟气。
(1)写出NaClO2溶液脱硝过程中反应的离子方程式___________________ 。
(2)由实验测得,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)采用NaClO、Ca(ClO) 2替代NaClO2,也能较好的除去SO2。从化学平衡原理分析,Ca(ClO) 2相比NaClO具有的优点是___________________。
Ⅱ.处理含H2S的烟气
生物脱H2S原理为:
H2S(g) + Fe2(SO4)3(aq) = S(s) + 2FeSO4(aq) + H2SO4(aq) ΔH1
4FeSO4(aq) + O2(g) + 2H2SO4(aq) ![]() 2Fe2(SO4)3(aq) + 2H2O(l) ΔH2
2Fe2(SO4)3(aq) + 2H2O(l) ΔH2
(1)反应2H2S(g) + O2 (g) = 2S(s) + 2H2O(l) 的ΔH3=___________________。
(2)若反应温度过高,反应速率下降(如图),其原因是______________。

Ⅲ.处理污水的化学方法有许多,混凝法、氧化还原法、中和法、电解法等。处理含Na2SO4的废水常用三室式电渗析法,原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。

(1)负极反应式为___________________。
(2)当电路中通过1![]() 电子的电量时,会有_________
电子的电量时,会有_________![]() 的O2生成。
的O2生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH3COOCH2CH3 与CH3CH2COOCH3 中均含有甲基、乙基和酯基,为同一种物质
B.![]() 和
和 ![]() 为同一物质
为同一物质
C.CH3CH2CH2CH2CH3 和CH3CH2CH(CH3)2 互为同素异形体
D.CH3CH2OH 和 CH2OHCHOHCH2OH 具有相同的官能团,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 与足量NaOH醇溶液共热,同时发生了两种反应。能证明发生了消去反应的操作与现象是( )
与足量NaOH醇溶液共热,同时发生了两种反应。能证明发生了消去反应的操作与现象是( )
A.反应混合物![]() 溴的颜色褪去
溴的颜色褪去
B.反应混合物![]()
![]() 产生白色沉淀
产生白色沉淀
C.反应混合物![]() 有机物
有机物![]() 紫色褪去
紫色褪去
D.反应混合物![]() 有机物
有机物![]() 溴的颜色褪去
溴的颜色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在测定硫酸铜晶体中结晶水含量的实验操作中:
(1)加热前应将晶体放在__________中研碎,加热是放在__________中进行,加热失水后,应放在__________中冷却。
(2)判断是否完全失水的方法是______________________________________________。
(3)下面是某学生一次实验的数据,请完成计算,填入下面的表格中。
坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | 测得晶体中结晶水个数 |
11.7 g | 22.7 g | 17. 6 g | _________ |
(4)这次实验中产生误差的原因可能是__________(填写字母)所造成。
A.硫酸铜晶体中含有易挥发性杂志 B.实验前晶体已部分变白
C.加热时固体部分变黑 D.加热失水后漏置在空气中冷却
(5)已知在坩埚中加热硫酸铜晶体,受热分解过程如下:
CuSO4·5H2O![]() CuSO4·3H2O
CuSO4·3H2O ![]() CuSO4·H2O
CuSO4·H2O ![]() CuSO4
CuSO4
有人借助如图封闭装置进行硫酸铜晶体脱水实验,回答下列问题:
①本实验可用于验证的化学定律是_____________________________。
②a处加热片刻后现象:______________________________________。
③你认为此装置设计是否合理.科学?如不合理,请写出理由:___________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯通入溴水中发生的化学反应方程式_______________________________________。实验室制取乙烯的化学反应方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃A,分子式为C8H16,A在一定条件下被氧化只生成一种物质B。则符合上述条件的烃A有几种(考虑顺反异构)
已知:
A. 3 B. 4 C. 6 D. 8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com