
【题目】下列说法中错误的是( )
A.从 CH4、NH4+、SO42- 为正四面体结构,可推测 PH4+、PO43-也为正四面体结构
B.1 mol 金刚石晶体中,平均含有 2 mol C—C 键
C.碱金属单质的熔点从 Li 到 Cs 逐渐减小
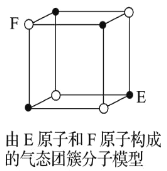
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为 EF 或 FE
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】将CO2气体缓缓地通入到含KOH、Ca(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述正确的是

A.D~E段沉淀减少的反应方程式是:CaCO3 + CO2 + H2O = Ca(HCO3)2
B.A~B段与C~D段发生反应的离子方程式都是:CO32- + CO2+H2O =2HCO3-
C.B~C段反应的离子方程式是:Ca(OH)2+CO2=CaCO3↓+H2O
D.O~A段反应的化方程式是:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaN3是一种易溶于水(NaN3=Na++N3-)的白色固体,可用于有机合成和汽车安全气囊的产气药等。钠法(液氨法)制备NaN3的工艺流程如下:
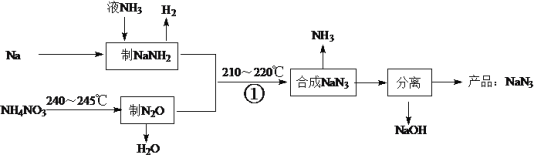
(1)钠元素在周期表中的位置是______________。
(2)NaN3中含有的化学键类型为_________________________________。
(3)NaNH2中氮元素的化合价为__________________。
(4)反应NH4NO3![]() N2O↑+2H2O↑中,每生成0.25molN2O转移电子数约_____个。
N2O↑+2H2O↑中,每生成0.25molN2O转移电子数约_____个。
(5)销毁NaN3可用NaClO溶液,该销毁反应的离子方程式为_______(N3-被氧化为N2)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式如图,下列关于该有机物的说法正确的是( )
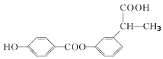
A.1 mol 该有机物可消耗 3 mol NaOHB.该有机物的分子式为 C16H17O5
C.最多可与 8 mol H2 发生加成D.苯环上的一溴代物有 6 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 X、Y、Z、W 的转化关系如图所示。下列说法错误的是( )
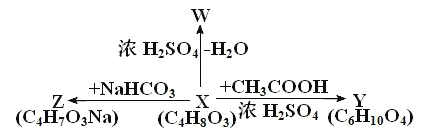
A.满足上述反应的 X 有五种B.Z 能发生取代反应
C.W 一定能使 Br2 的 CCl4 溶液褪色D.Y 含有两种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为几种晶体或晶胞的示意图:
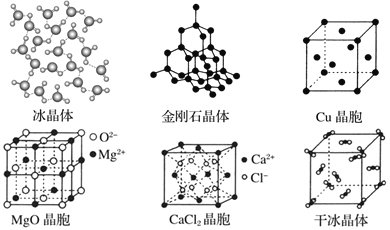
请回答下列问题:
(1)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_____。
(2)MgO晶体中,距每个O2-最近且距离相等的O2-有_____个。
(3)每个Cu晶胞中实际占有_____个Cu原子;CaCl2晶体中Ca2+的配位数为_____。
(4)冰的熔点远高于干冰,除 H2O 是极性分子、CO2 是非极性分子外, 还有一个重要的原因是____。
(5)金刚石晶胞含有_________个碳原子;若碳原子半径为 r,根据硬球接触模型,列式表示碳原子在晶胞中的空间占有率_____(计算结果为含π的分数,不要化为小数或百分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。试回答下列问题:
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:__。
②写出过量铁与稀硝酸反应的离子方程式:__。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__。上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__Al+__NO3-+__OH-+__=__[Al(OH)4]-+__N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__,反应中转移电子0.3mol,生成__mL(标准状况下)N2。
【答案】Fe+NO3-+4H+=Fe3++NO↑+2H2O 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O 2∶3 40 10 6 4 18H2O 10 3 10∶3 672
【解析】
(1)①铁与过量稀硝酸反应生成硝酸铁、NO和水,离子方程式为Fe+NO3-+4H+=Fe3++NO↑+2H2O;
②过量铁与稀硝酸反应生成硝酸亚铁、NO和水,离子方程式为3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O;
③28g铁的物质的量为0.5mol,与含1.6mol硝酸的稀硝酸恰好完全反应,设生成的Fe3+和Fe2+的物质的量分别是xmol、ymol,即生成xmol硝酸铁和ymol硝酸亚铁,根据N原子守恒知,生成NO的物质的量为(1.6-3x-2y)mol,根据得失电子守恒有3x+2y=3(1.6-3x-2y),又有x+y=0.5,解得x=0.2,y=0.3,则生成的Fe3+和Fe2+的物质的量之比为2∶3;上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,由于生成的氢氧化亚铁在空气中易被氧化为氢氧化铁,氢氧化铁受热分解最终得到的固体是氧化铁,故其物质的量为0.5mol×![]() =0.25mol,质量为40g;
=0.25mol,质量为40g;
(2)①根据得失电子守恒、原子守恒及电荷守恒,可知离子方程式为10Al+6NO3-+4OH-+18H2O=10[Al(OH)4]-+3N2↑;
②上述反应中,还原剂是Al,还原产物是N2,其物质的量之比为10∶3;由方程式可知,生成3molN2时转移电子30mol,所以反应中转移电子0.3mol,生成N2的体积(标准状况下)为![]() ×22.4L·mol-1=0.672L=672mL。
×22.4L·mol-1=0.672L=672mL。
【点睛】
金属与硝酸反应的计算一般常采用以下方法:①原子守恒法:HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量;②得失电子守恒法:HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得到电子的物质的量等于金属失电子的物质的量;③电荷守恒法:HNO3过量时反应后溶液中(不考虑OH-)有:c(NO3-)=c(H+)+nc(Mn+)(Mn+代表金属离子);④离子方程式计算法:金属与H2SO4、HNO3的混合酸反应时,由于溶液中NO3-在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO3-进行相关计算,且溶液中要符合电荷守恒。
【题型】综合题
【结束】
21
【题目】如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:

(1)写出N2的一种用途:___。
(2)HNO3与图中的物质C
(3)实验室制取物质B的化学方程式为____。
(4)NO2与水反应生成物质A的化学方程式为____。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSe、MgB2、Nb3Al等超导材料具有广泛应用前景。
(1)Fe2+基态价电子的轨道表示式(价电子排布图)__,Se、Mg、B三种元素的电负性大小顺序是__。
(2)蒸气状态下以二聚分子存在的A1Cl3的结构式是___,其中A1原子的杂化方式是___,分子中八个原子___(选填“是”或“不是”)在同一平面上,该分子是____(选填“极性“或“非极性“)分子。
(3)制备FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2过程中需将金属锂溶于液氨,从而制得具有很高反应活性的金属电子溶液,反应为:Li+(m+n)NH3—X+e-(NH3)n。
①X的化学式为____;
②NH3的价层电子对互斥模型是 ____。
(4)MgB2晶体结构中的B原子层具有类似石墨的层状结构,且被六方密排的Mg原子层隔开,B原子位于Mg原子组成的三棱柱的中心。已知:平面中Mg原子间的最近核间距为acm,平面间Mg原子间的最近核间距为bcm,阿伏加德罗常数为NA。
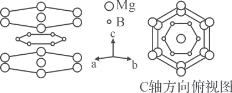
①B原子层六元环中处于对位的B原子核间距为____cm。
②MgB2晶体的密度是____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如图所示,下列说法正确的是
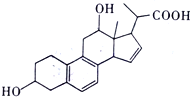
A. 该有机物的分子式为C21H24O4
B. 该有机物共有四种官能团,分别是:羟基、羧基、苯环、碳碳双键
C. 该有机物最多消耗NaOH与NaHCO3的物质的量比为1:1
D. 1mol 该有机物与足量金属钠反应,生成33.6L氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com