
【题目】工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3,难溶于水),其中一部分铁元素在风化过程中会转化为+3价。

已知:TiOSO4遇水会水解。
(1)步骤①中,钛酸亚铁与硫酸反应的离子方程式为__________________。
(2)步骤③中,实现混合物的分离是利用物质的___________(填字母序号)。
a. 熔沸点差异 b. 溶解性差异 c. 氧化性、还原性差异
(3)步骤④的操作是_______________(填操作名称)。

(4)步骤④中将TiO2+转化为H2TiO3的原理TiO2++2H2O ![]() H2TiO3+ 2H+,该反应的△H_______0(填>或<);加水稀释,平衡_________(填“正向”、“逆向”或“不”)移动。
H2TiO3+ 2H+,该反应的△H_______0(填>或<);加水稀释,平衡_________(填“正向”、“逆向”或“不”)移动。
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为__________________________。
(6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。在制备金属钛前后,CaO的总量不变,其原因是(请用化学方程式解释)______________________________。
【答案】 FeTiO3 + 4H+ = Fe2+ + TiO2++2H2O b 过滤 > 正向 MnO2 + 2Fe2+ + 4H+ === Mn2+ + 2Fe3+ + 2H2O 2CaO === 2Ca + O2↑, 2Ca + TiO2 ![]() Ti + 2CaO,或: 阴极:2Ca2+ + 4e- == 2Ca 阳极:2O2- - 4e- == O2↑,2Ca + TiO2
Ti + 2CaO,或: 阴极:2Ca2+ + 4e- == 2Ca 阳极:2O2- - 4e- == O2↑,2Ca + TiO2 ![]() Ti + 2CaO
Ti + 2CaO
【解析】本题考查化学工艺流程,(1)根据流程①,以及FeTiO3难溶于水,因此钛酸亚铁与硫酸反应的离子方程式为:FeTiO3 + 4H+= Fe2++ TiO2++2H2O;(2)步骤③是冷却结晶,得到FeSO4·7H2O,因此利用的是物质的溶解性差异,故b正确;(3)步骤④在热水中得到沉淀和溶液,因此操作步骤是过滤;(4)步骤④是在热水中进行,相当于升温,平衡向生成H2TiO3方向进行,根据勒夏特列原理,该反应是吸热反应,即△H>0,,加水稀释,离子浓度降低,根据勒夏特列原理,应向正反应方向进行移动;(5)废液中含有Fe2+,以还原性为主,MnO2作氧化剂,被还原成+2价Mn,Fe2+被氧化成Fe3+,因此有Fe2++MnO2+→Fe3++Mn2+,根据化合价升降进行配平,即有MnO2+2Fe2+→Mn2++2Fe3+,根据电荷守恒和原子守恒,因此离子反应方程式为:MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O;(6)根据电解装置图,在阴极上发生Ca2++2e-=Ca,阳极上发生2O2--4e-=O2,总反应式为2CaO ![]() 2Ca+O2↑,根据装置图,以及整个过程中CaO的总量不变,说明在装置的右侧产生CaO,即发生的反应是2Ca + TiO2 = Ti + 2CaO。
2Ca+O2↑,根据装置图,以及整个过程中CaO的总量不变,说明在装置的右侧产生CaO,即发生的反应是2Ca + TiO2 = Ti + 2CaO。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某气体的摩尔质量为M gmol﹣1 , NA表示阿伏伽德罗常数,在一定的温度和压强下,体积为V L的该气体所含有的分子数为x.则 ![]() 表示的是( )
表示的是( )
A.V L该气体的质量(以g为单位)
B.1 L该气体的质量(以g为单位)
C.1 mol该气体的体积(以L为单位)
D.1 L该气体中所含的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活、社会可持续发展密切相关,保护环境问题已经广泛引起人们关注,下列说法不利于环境保护的是
A. 加快化石燃料的开采与使用
B. 推广使用节能环保材料
C. 推广新能源汽车替代燃油汽车
D. 用晶体硅制作太阳能电池将太阳能直接转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).请回答下列问题: 
(1)A为实验室制氯气的发生装置,反应原理为(填化学方程式).某学生用12molL﹣1的浓盐酸100mL和足量的MnO2反应制Cl2 , 实际得到的Cl26.72L(1分)(填“<”或“>”或“=”).
(2)漂白粉将在U形管中产生,其化学方程式为 .
(3)此实验所得漂白粉的有效成分偏低.该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2 , 为避免此副反应的发生,可采取的措施是 .
②试判断另一个副反应是 , 为避免此副反应的发生,可将装置作何改进 .
(4)C装置的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH2=-1452 kJ·mol-1
③H+(aq)+OH-(aq)=H2O(l) ΔH3=-57.3 kJ·mol-1
下列说法正确的是( )
A. H2(g)的燃烧热为571.6 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)=![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( ) 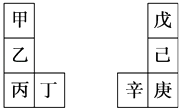
A.丙与庚的原子核外电子数相差3
B.原子半径:辛>己>戊
C.金属性:甲>乙>丁
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2:3.请回答下列问题:
(1)元素X的名称是 , 丙分子的电子式为 .
(2)若甲与Y单质在常温下混合就有明显现象,则甲的化学式为 . 丙在一定条件下转化为甲和乙的反应的化学方程式为 .
(3)化合物丁含X,Y,Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1:1混合后所得物质戊的晶体结构中含有的化学键为:(选填序号).
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.纤维素和淀粉遇碘水均显蓝色B.蛋白质、乙酸和葡萄糖均属于电解质
C.制镜业可使用葡萄糖做还原剂D.乙酸乙酯和食用植物油均可水解生成乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com