
【题目】下列关于化学反应的说法正确的是( )
A. 有单质生成的化学反应,一定是氧化还原反应
B. 金属单质在氧化还原反应中只能作还原剂
C. 有非金属单质参加的化合反应,非金属单质一定是氧化剂
D. 有气体生成的化学反应一定是氧化还原反应
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】亮菌甲素为利胆解痉药,适用于急性胆嚢炎治疗,其结构简式如图。下列有关叙述中正确的是( )

A. 分子中所有碳原子不可能共平面
B. 1mol亮菌甲素与澳水反应最多消耗3molBr2
C. 1mol亮菌甲素在一定条件下与Na0H溶液完全反应最多消耗2molNaOH
D. 1mol亮菌甲素在一定条件下可与6molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3∶2,则样品中铁、铝物质的量之比为( )
A.3∶2 B.2∶1
C.3∶4 D.4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,其产量通常用来衡量一个国家的石油化工水平。在一定条件下,有如下转化:

(1)乙烯的电子式是___________________。
(2)由重油生产乙烯的裂解反应属于_________________(填“化学”或“物理”)变化。
(3)乙烯转化为乙醇的反应类型是__________________。
(4)乙醇转化为A的化学方程式是____________________________________________。
(5)工业上乙烯通过聚合反应可得到高分子化合物B,反应的化学方程式是_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用乙醛生产PTT(聚酯)和化合物M 的某种合成路线如下:

回答下列问题:
(1)A中官能团名称为______.
(2)B生成C的反应类型为_______。
(3)C的结构简式为_______,D化学名称是_______。
(4)由D生成PTT的化学方程式为____________________。
(5)芳香化合物W是M的同分异构体,它的溶液滴入FeCl3溶液显紫色,W共有______种(不含立体结构),其中核磁共振氢谱为四组峰的结构简式为_________。
(6)参照上述合成路线,以乙醇和1,3-丁二烯为原料(无机试剂任选),设计制备合成 路线___________________。
路线___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国规定食盐的含碘量(按每千克食盐含碘元素计)为20mgkg﹣1~40mgkg﹣1 , 则每千克食盐加入碘酸钾(KIO3)的物质的量应不少于 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解尿素[CO(NH3)2]的碱性溶液制氢气的装置如图所示。下列说法错误的是
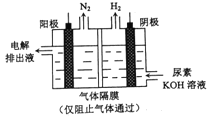
A. 为增强导电性,可用金属铜作阳极
B. 电解过程中阴、阳极产生的气体物质的量之比为3:1
C. 阴极的电极反应式为:2H2O+2e-=H2+2OH-
D. 阳极的电极反应式为:CO(NH2)2-6e-+8OH-=CO32-+N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知: Fe3O4能与高浓度盐酸反应,与低浓度盐酸不反应。某研究性学习小组通过实验探究,欲确定某地所产青砖中是否含有FeO、Fe3O4和Fe2O3, 并测定青砖中铁元素的质量分数。回答下列问题:
(一)实验准备
(l)本实验探究部分需在无氧环境下进行,故配制溶液的蒸馏水常用_____法除去溶解氧。该实验所用试管中均需充满CO2,请选用下列装置制取干燥纯净的CO2气体,连接顺序为:
a![]() _____
_____![]() h、i(后续装置略去)。
h、i(后续装置略去)。

(二)探究青砖中是否含有Fe3O4和Fe2O3
组别 步骤及现象 | 第一组 | 第二组 | 第三组 |
步骤一 | 取试管l 、2 、3①分别加入2g青砖细粉②分别通入CO2气体至充满,用户塞子塞紧 | ||
步骤二 | 向试管1中注入10mL 3 mol/L盐酸,充分振荡 | 向试管2中注入10mL 6 mol/L盐酸,充分振荡 | 向试管3中注入10mL 12 mol/L盐酸,充分振荡 |
步骤三 | 取试管1、2、3中的上层清液各1mL于另三支试管中,再分别注入0.2mL相同浓度的KSCN溶液,振荡 | ||
步骤三的实验现象 | 溶液变红 且第一、二两组溶液颜色深浅相同 | 溶液变红 且较第一、二两组颜色更深 | |
(2)步骤二中,若不取下试管上的塞子,又不因盐酸加入导致试管内压强增大,使用注射器实现上述目的的操作方法为__________。
(3)Fe3O4与高浓度盐酸反应的离子方程式为________。
(4)用离子方程式表示溶液变红的原因__________。
(5)根据上述现象,可初步得出该青砖样品中所含铁的氧化物为________(填化学式)
(三)探究青砖中是否含有FeO
(6)另取一支充满CO2气体的试管,注入1mL上述试管1的上层清液和数滴K3[Fe(CN)6]溶液,若实验现象为_______,说明青砖中含有FeO。
(四)青砖样品中铁元素质量分数的测定
称取m1g 青砖细粉,用足量12mol/L盐酸充分溶解、过滤、洗涤(第一次)。将滤液(包括洗涤滤渣后的溶液)依次与足量的新制氯水、氢氧化钠溶液充分反应,过滤、洗涤(第二次),将沉淀灼烧至恒重,冷却后称得残留固体质量为m2g。
(7)若青砖中其它成分对实验无影响,则测得铁元素的质量分数为____(填含m1、m2的表达式);该实验若未进行第一次洗涤,则测得铁元素的质量分数______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在花瓶中插上一束美丽的鲜花,将会给你紧张而又忙碌的学习、生活带来轻松和愉悦的心情。可是过不了几天,花儿就会枯萎。如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成 分 | 质 量(g) | 摩尔质量(g/mol) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是_________(填字母)。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中的K+的物质的量浓度约为_________(阿司匹林中不含K+)。
(3)配制上述1L“鲜花保鲜剂”所需的仪器有:量筒、烧杯、玻璃棒、托盘天平、药匙、___________________。(填所缺仪器的名称)。
(4)在溶液配制过程中,下列操作对配制结果没有影响的是______(填字母)。
A.定容用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)实验室用固体加热制氨气的化学反应方程式为:___________________________。
(6)若将收集到的氨气溶于水配成100 mL的溶液,所得氨水中NH3物质量浓度(不考虑NH3与H2O的反应)为0.3 mol·L-1,则需要氨气的体积为________mL(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com