
【题目】己知: Fe3O4能与高浓度盐酸反应,与低浓度盐酸不反应。某研究性学习小组通过实验探究,欲确定某地所产青砖中是否含有FeO、Fe3O4和Fe2O3, 并测定青砖中铁元素的质量分数。回答下列问题:
(一)实验准备
(l)本实验探究部分需在无氧环境下进行,故配制溶液的蒸馏水常用_____法除去溶解氧。该实验所用试管中均需充满CO2,请选用下列装置制取干燥纯净的CO2气体,连接顺序为:
a![]() _____
_____![]() h、i(后续装置略去)。
h、i(后续装置略去)。

(二)探究青砖中是否含有Fe3O4和Fe2O3
组别 步骤及现象 | 第一组 | 第二组 | 第三组 |
步骤一 | 取试管l 、2 、3①分别加入2g青砖细粉②分别通入CO2气体至充满,用户塞子塞紧 | ||
步骤二 | 向试管1中注入10mL 3 mol/L盐酸,充分振荡 | 向试管2中注入10mL 6 mol/L盐酸,充分振荡 | 向试管3中注入10mL 12 mol/L盐酸,充分振荡 |
步骤三 | 取试管1、2、3中的上层清液各1mL于另三支试管中,再分别注入0.2mL相同浓度的KSCN溶液,振荡 | ||
步骤三的实验现象 | 溶液变红 且第一、二两组溶液颜色深浅相同 | 溶液变红 且较第一、二两组颜色更深 | |
(2)步骤二中,若不取下试管上的塞子,又不因盐酸加入导致试管内压强增大,使用注射器实现上述目的的操作方法为__________。
(3)Fe3O4与高浓度盐酸反应的离子方程式为________。
(4)用离子方程式表示溶液变红的原因__________。
(5)根据上述现象,可初步得出该青砖样品中所含铁的氧化物为________(填化学式)
(三)探究青砖中是否含有FeO
(6)另取一支充满CO2气体的试管,注入1mL上述试管1的上层清液和数滴K3[Fe(CN)6]溶液,若实验现象为_______,说明青砖中含有FeO。
(四)青砖样品中铁元素质量分数的测定
称取m1g 青砖细粉,用足量12mol/L盐酸充分溶解、过滤、洗涤(第一次)。将滤液(包括洗涤滤渣后的溶液)依次与足量的新制氯水、氢氧化钠溶液充分反应,过滤、洗涤(第二次),将沉淀灼烧至恒重,冷却后称得残留固体质量为m2g。
(7)若青砖中其它成分对实验无影响,则测得铁元素的质量分数为____(填含m1、m2的表达式);该实验若未进行第一次洗涤,则测得铁元素的质量分数______(填“偏高”、“偏低”或“无影响”)。
【答案】 煮沸 d、e![]() b、c 用两支注射器刺穿塞子插入试管中,其中一支抽出10mL气体,同时另一支注入10mL盐酸 Fe3O4+8H+=Fe2++2Fe3++4H2O Fe3++3SCN-=Fe(SCN)3 Fe2O3、Fe3O4 生成蓝色沉淀 7m2/(10m1)×100% 偏低
b、c 用两支注射器刺穿塞子插入试管中,其中一支抽出10mL气体,同时另一支注入10mL盐酸 Fe3O4+8H+=Fe2++2Fe3++4H2O Fe3++3SCN-=Fe(SCN)3 Fe2O3、Fe3O4 生成蓝色沉淀 7m2/(10m1)×100% 偏低
【解析】(l)蒸馏水中含有溶解氧,而本实验需在无氧环境下进行,则需要将蒸馏水煮沸;用盐酸和碳酸钙制取CO2中混有HCl和水汽,需要用饱和碳酸氢钠溶液除去HCl、用浓硫酸干燥,根据气流方向,装置的连接顺序为a![]() d、e
d、e![]() b、c
b、c ![]() h、i;
h、i;
(2)步骤二中,用注射器添加盐酸的操作方法是用两支注射器刺穿塞子插入试管中,其中一支抽出10mL气体,同时另一支注入10mL盐酸;
(3) Fe3O4与高浓度盐酸反应生成氯化铁和氯化亚铁,根据电荷守恒和原子守恒,此反应的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O;
(4)在含有Fe3+的溶液中滴加KSCN溶液,溶液变红色,是因为 Fe3++3SCN-=Fe(SCN)3;
(5)上述实验中浓盐酸和稀盐酸溶解后的溶液中均含有Fe3+,即说明该青砖样品中所含铁的氧化物有 Fe2O3、Fe3O4;
(6)若溶液中滴加K3[Fe(CN)6]溶液会出现生成蓝色沉淀,说明溶液中含有Fe2+,即青砖中含有FeO;
(7)残留固体为Fe2O3,质量为m2g,则物质的量为![]() =
=![]() mol,,则测得铁元素的质量分数为
mol,,则测得铁元素的质量分数为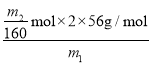 ×100%=
×100%=![]() ×100%;若第一次不洗涤,则浅渣表面附着的Fe2+、Fe3+未全部转移到溶液中,最终测定结果偏低。
×100%;若第一次不洗涤,则浅渣表面附着的Fe2+、Fe3+未全部转移到溶液中,最终测定结果偏低。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铝盐和铁盐都可以作净水剂.
B. 在饱和Na2CO3溶液中通入CO2没有任何现象
C. 将CO2通入CaCl2溶液中至饱和,有沉淀产生
D. 用澄清石灰水可区别Na2CO3和NaHCO3粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应的说法正确的是( )
A. 有单质生成的化学反应,一定是氧化还原反应
B. 金属单质在氧化还原反应中只能作还原剂
C. 有非金属单质参加的化合反应,非金属单质一定是氧化剂
D. 有气体生成的化学反应一定是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如图所示。
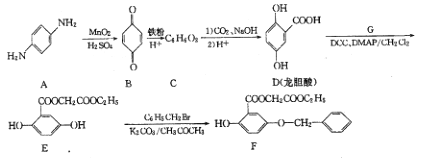
(1)A的水溶液呈_____________(填“酸性”、“碱性”);
(2)C的结构简式为_____________;
(3)写出E→F反应的化学方程式_____________;
(4)写出符合下列条件的龙胆酸乙酯(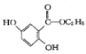 )的一种同分异构体的结构简式_____________;
)的一种同分异构体的结构简式_____________;
①能发生银镜反应
②不与FeCl3溶液发生显色反应但其水解产生之一能与FeCl3溶液发生显色反应
③核磁共振氢谱有四组峰,且峰面积之比为6:2:1:1
(5)参照上述合成路线,设计一条以氯苯、乙醇为原料制备水杨酸乙酯(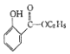 )的合成路线流程图(无机试剂任用),相关信息:
)的合成路线流程图(无机试剂任用),相关信息: 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 使元素的化合态转化成游离态的过程就是还原的过程
B. 金属冶炼的实质是金属元素被氧化
C. 电解熔融氧化铝时,每还原出1 kg铝,必有约111mol电子转移
D. 工业上常用电解NaCl水溶液的方法制取金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列实验方法操作,能达到要求的是
A. 用托盘天平称量25.20g氯化钠固体
B. 实验室制取蒸馏水时,圆底烧瓶中加些碎瓷片防止暴沸
C. 将4gNaOH固体倒入盛有1L水烧杯中配置成0.1mol/L烧碱溶液
D. 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用海水提取粗盐后得到的苦卤(含Mg2+、Ca2+、Br-等离子的溶液)提取Br2并制备含镁化合物。部分工艺流程设计如下:

回答下列问题:
(1)步骤I中用硫酸酸化可抑制氯气与水的反应,原因是____(结合离子方程式回答)。
(2)工业上常用Na2CO3法或SO2法实现含Br2混合气到液溴的转化,流程如下:
Na2CO3法:
![]()
SO2法:
![]()
① Na2CO3法中步骤Ⅲ的反应有气体生成,离子方程式为______。步骤V中蒸馏时蒸气出口温度通常控制在65-75℃,若温度过低,溴蒸出不充分;若温度过高,则会导致液溴中混有较多的____________。
② SO2法对比Na2CO3法的缺点是__________(答出一条即可)。
(3)提溴后所得含Mg2+、Ca2+的溶液可设计如下流程制各碱式碳酸镁[Mg5(OH)2(CO3)4·4H2O]和无水氯化镁:

① 步骤Ⅷ的化学方程式为_________。
② 若步骤X中生成的CO与CO2物质的量之比为3:1,写出反应的化学方程式__________。
③25℃,步骤Ⅵ生成Mg(OH)2沉淀后,若溶液中残留的Mg2+浓度为l.8×10-6mol/L 。则溶液的pH为________;此pH下,欲使Mg(OH)2沉淀中不含Ca(OH)2,则溶液中c(Ca2+)不能大于____(已知:25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Ca(OH)2]=5.5×10-6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能说明发生了化学变化的是( )
A.变化时有电子的得失或共用电子对的形成
B.变化过程中有旧化学键的断裂和新化学键形成
C.变化时释放出能量
D.变化前后原子的种类和数目没有改变,分子种类增加了
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com