
【题目】硅是最理想的太阳能电池材料,高性能晶硅电池是建立在高质量晶硅材料基础上的。工业上可以用如图所示的流程制取高纯硅。

(1)硅在周期表中的位置是_______________,反应1中氧化剂与还原剂的物质的量之比为:__________________
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3 (沸点31.8℃)中含有少量SiCl4 (沸点57.6℃)和SiH2Cl2 (沸点8.2℃)、SiH3Cl(沸点-30.4℃)提纯SiHCl3采用的方法为__________,整个过程中可以循环利用的物质X是:_____________(填化学式)
(3)提纯粗硅的过程中必须严格控制无水无氧,原因之一是硅的卤化物极易水解,写出SiCl4遇水剧烈反应的化学方程式___________________________________
(4)硅在有HNO3存在的条件下,可以与HF生成H2SiF6,同时有不溶于水的气体生成,该气体遇空气变为红棕色,硅单质发生的化学方程式为_____________________________________________________
(5)某工厂用100吨纯度为75%的石英砂为原料经第一步反应制得的粗硅中含硅28吨,则该过程中硅的产率是:__________(精确到小数点后两位)
【答案】 第三周期第IVA族 1:2 蒸馏或分馏 HCl SiCl4+3H2O=H2SiO3↓+4HCl或3SiCl4+4H2O=H3SiO4↓+4HCl 3Si+4HNO3+18HF=3H2SiF6+4NO↑+8H2O 0.80或80.00%
【解析】(1)硅是14号元素,在周期表中位于第三周期第IVA族,反应1为二氧化硅和碳的反应:SiO2+3C![]() SiC+2CO,反应中氧化剂是二氧化硅和C,还原剂是C,氧化剂和还原剂的物质的量之比为1:2,故答案为:第三周期第IVA族;1:2;
SiC+2CO,反应中氧化剂是二氧化硅和C,还原剂是C,氧化剂和还原剂的物质的量之比为1:2,故答案为:第三周期第IVA族;1:2;
(2)SiHCl3(沸点31.8℃)中含有少量SiCl4(沸点57.6℃)和SiH2Cl2 (沸点8.2℃)、SiH3Cl(沸点-30.4℃),由于沸点差别较大,可以通过分馏除去杂质;氯化氢与粗硅反应生成SiHCl3,SiHCl3与氢气又反应生成硅和氯化氢,氯化氢可以循环利用,故答案为:分馏;HCl;
(3)提纯粗硅的过程中必须严格控制无水无氧,原因之一是硅的卤化物极易水解,SiCl4遇水剧烈反应的化学方程式为SiCl4+3H2O=H2SiO3↓+4HCl,故答案为:SiCl4+3H2O=H2SiO3↓+4HCl;
(4)硅在有HNO3存在的条件下,可以与HF生成H2SiF6,同时有不溶于水的气体生成,该气体遇空气变为红棕色,说明生成了一氧化氮,反应的化学方程式为3Si+4HNO3+18HF=3H2SiF6+4NO↑+8H2O,故答案为:3Si+4HNO3+18HF =3H2SiF6+4NO↑+8H2O;
(5)100吨纯度为75%的石英砂中含有二氧化硅的质量为75t,其中含有硅元素75t×![]() =35t,经第一步反应制得的粗硅中含硅28吨,该过程中硅的产率=
=35t,经第一步反应制得的粗硅中含硅28吨,该过程中硅的产率=![]() ×100%=80.00%,故答案为:80.00%。
×100%=80.00%,故答案为:80.00%。


科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。工业上可通过以下反应制得ClO2(提示:下面方程式中的氧元素都为负二价)2KClO3+Na2SO3+H2SO4![]() 2ClO2↑+K2SO4+Na2SO4+H2O,则下列说法中正确的是
2ClO2↑+K2SO4+Na2SO4+H2O,则下列说法中正确的是
A. KClO3在反应中是还原剂
B. 制得1mol的ClO2反应中需转移2mol电子
C. Na2SO3的还原性小于ClO2的还原性
D. 反应中被氧化的元素是S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
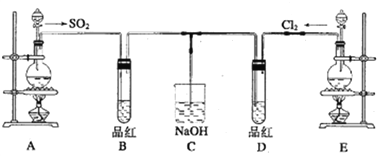
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,该同学怎样操作可以使分液漏斗液体顺利滴下___________________________;
(2)实验室用装置E制备Cl2,其反应的化学方程式为____________________,若实验室用酸性KMnO4和浓盐酸反应制Cl2,反应的离子方程式为________________________。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液都褪色,停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:
B:_______________________,D:_________________________。
(4)若将B中品红换成Na2S溶液,通SO2一段时间后B中现象为_____________________。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是( )
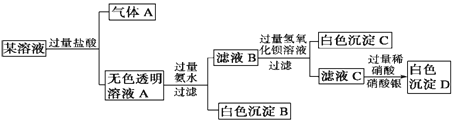
A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl- 四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++ 3OH- = Al(OH)3 ↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水玻璃中通入少量的CO2气体,充分反应后加热蒸干,再高温充分灼烧,冷却后所得的固体物质为()
A. Na2SiO3 B. Na2SiO3与Na2CO3
C. SiO2与Na2CO3 D. SiO2、Na2SiO3及Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。

根据上述实验,以下推测不正确的是
A. 原溶液一定不存在H+、Cu2+、CO32-
B. 不能确定原溶液是否含有K+、NO3-
C. 实验所加的NaOH的浓度为2mol·L-1
D. 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,下列有关说法正确的是
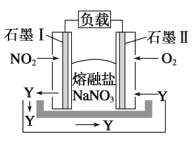
A. 石墨I极为正极,石墨II极为负极
B. Y的化学式可能为NO
C. 石墨I极的电极反应式为NO2+NO3--e-=N2O5
D. 石墨II极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以______(填“促进”或“抑制”)其水解.
(2)明矾可用于净水,原因是(用离子方程式表示):____________________
(3)泡沫灭火器灭火原理(用离子方程式表示)_____________________
(4)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有以下几种方法:①热分解法;②焦炭法;③水煤气法(CO或H2);④活泼金属置换法;⑤电解法。这几种方法各有优缺点,它们在工业上均有应用。古代有:a.火烧孔雀石炼铜;b.湿法炼铜;现代有:c.铝热法炼铁;d.光卤石法炼镁。对它们的冶炼方法分析不正确的是
A. a用② B. b用③ C. c用④ D. d用⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com