
【题目】某兴趣小组要进行有关氢气的定量测定实验,为保证氢气不损失,设计用甲、乙两装置及橡胶管完成锌粒和稀硫酸制取氢气的操作。步骤如下:
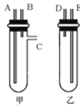
①将锌粒放于______(填“甲”或“乙”,下同)装置中,将稀硫酸放于______装置中。
②用橡胶管连接对应接口(填编号):A接______,B接______。
③将盛稀硫酸的试管倒置,即可发生反应放出气体。
科目:高中化学 来源: 题型:
【题目】25℃时,将 1.0 L w mol·L-1 CH3COOH 溶液与 0.1 mol NaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图。下列叙述正确的是
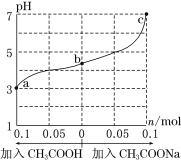
A.b点混合液中c(Na+)>c(CH3COO-)
B.加入CH3COOH过程中,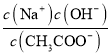 增大
增大
C.c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w
D.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体[CH3CH(OH)COO]2Fe·3H2O(M=288 g/mol)是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸CH3CH(OH)COOH与FeCO3反应制得.
I.制备碳酸亚铁
(1)利用如图所示装置进行实验。装置中仪器C的名称是____________。
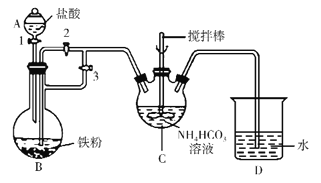
(2)实验开始时,首先关闭活塞2,打开活塞1、3,目的是________________________;关闭活塞1,反应一段时间后,关闭活塞_________,打开活塞___________,观察到B中溶液进入到C中,C中产生沉淀和气体。生成FeCO3的离子方程式为__________。
(3)装置D的作用是___________________。
Ⅱ.乳酸亚铁晶体的制备及纯度测定
将制得的FeCO3加入到乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸,从所得溶液中获得乳酸亚铁晶体。
(4)加入少量铁粉的作用是______________________________。
(5)用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其主要原因是____________________________________________。
(6)经查阅文献后,改用Ce(SO4)2标准溶液进行滴定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760 g样品,溶解后进行必要处理,用容量瓶配制成250 mL溶液,每次取25.00 mL,用0.1000 mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表所示:

则产品中乳酸亚铁晶体的纯度为________%(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,可逆反应N2 + 3H2![]() 2NH3 达到平衡状态的标志是
2NH3 达到平衡状态的标志是
A. N2、H2、NH3在容器中共存
B. 混合气体的总物质的量不再发生变化
C. 单位时间内生成n mol N2,同时生成3n mol H2
D. 单位时间内消耗n mol N2,同时消耗n mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某空间站中宇航员的呼吸保障系统原理如图所示。
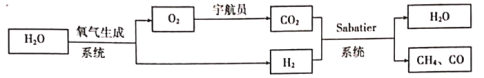
Sabatier系统中发生反应为:
反应I:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)△H1
CH4(g)+2H2O(g)△H1
反应II:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2=+41.2kJ/mol
CO(g)+H2O(g)△H2=+41.2kJ/mol
(1)常温常压下,已知:
①H2和CH4的燃烧热(△H)分别为-285.5kJ·mol-1和-890.0kJ·mol-1;
②H2O(l)=H2O(g)△H3=+44.0kJ·mol-1。则△H1=__________kJ·mol-1。
(2)按![]() =4的混合气体充入Sabatier系统,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图所示;不同压强时,CO2的平衡转化率如图所示:
=4的混合气体充入Sabatier系统,当气体总压强为0.1MPa,平衡时各物质的物质的量分数如图所示;不同压强时,CO2的平衡转化率如图所示:
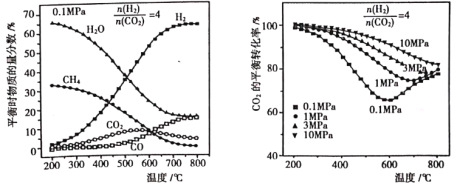
①Sabatier系统中应选择适宜的温度是__________。
②200~550℃时,CO2的物质的量分数随温度升高而增大的原因是__________。
③当温度一定时,随压强升高,CO2的平衡转化率增大,其原因是__________。
(3)一种新的循环利用方案是用Bosch反应[CO2(g)+2H2(g)![]() C(s)+2H2O(g)]代替Sabatier系统。
C(s)+2H2O(g)]代替Sabatier系统。
①分析Bosch反应的熵值变化为:△S__________0(选填“>”或“<”)。
②温度一定时,在2L密闭容器中按![]() =2投料进行Bosch反应,达到平衡时体系的压强为原来压强p0的0.7倍,该温度下反应平衡常数Kp为__________(用含p0的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
=2投料进行Bosch反应,达到平衡时体系的压强为原来压强p0的0.7倍,该温度下反应平衡常数Kp为__________(用含p0的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③下列措施能提高Bosch反应中CO2转化率的是_________(填标号)。
A.加快反应器中气体的流速B.提高原料气中CO2所占比例
C.增大催化剂的表面积D.反应器前段加热,后段冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组比较Cl-、Br-、I-的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 试管内颜色无明显变化;用蘸浓氨水的玻璃棒靠近管口,产生白烟。 | 溶液变黄;把湿润的KI淀粉试纸靠近试管口,变蓝。 | 溶液变深紫色;经检验溶液含单质碘。 |
下列对实验的分析合理的是
A.实验1中,白烟是(NH4)2SO4
B.根据实验1和实验2判断还原性:Br->Cl-
C.根据实验3判断还原性:I->Br-
D.上述实验利用了浓H2SO4的强酸性、强氧化性等性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.同温同压下,1 mol N2与1 mol CO可能具有不同的体积
B.同温同压下,二氧化碳与笑气(化学式为N2O)的密度相同
C.质量相同的O2与O3,一定具有相同的原子数
D.28 g CO与1 mol CO一定具有相同的碳原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取Ni2O3.已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如图所示:
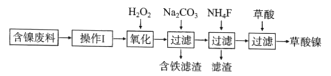
回答下列问题:
(1)“操作I”为“酸浸”,为了提高酸浸的效率,可以采取的措施为__________(写出两条)。
(2)加入H2O2发生的主要反应的离子方程式为________________
(3)加入碳酸钠溶液调pH至4.0~5.0,其目的是___________________
(4)将草酸镍(NiC2O4·2H2O)在热空气中干燥脱水,再采用高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为水蒸气和_________________
(5)工业上还可用电解法制取Ni2O3用NaOH溶液调 NiCl2,溶液的pH至7.5,加入适量Na 2SO4后利用惰性电极电解。电解过程中产生的Cl2,有80%在弱碱性条件下生成CIO-,再把二价镍氧化为三价镍。CIO-氧化Ni(OH)2生成Ni2O3的离子方程式为_______________________amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为_______mol.
(6)以Al和NiO(OH)为电极,NaOH溶液为电解液组成原电池,放电时NiO(OH)转化为Ni(OH)2,则放电时负极的电极反应式为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两种常见金属元素的相对原子质量之比是8∶9。将两种金属单质按物质的量之比为3∶2组成1.26g混合物。将此混合物与足量稀硫酸反应,放出1.344L(标准状况)氢气。若这两种金属单质在反应中生成氢气的物质的量相等,求A、B两金属的摩尔质量各为多少___?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com