
分析 (1)根据物质导电的原因分析,只要含有自由移动的离子或自由电子即可;
(2)根据电解质的定义分析,在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;
(3)非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
(4)在水溶液中能够完全电离的电解质是强电解质.
解答 解:①水是化合物,含有自由移动离子能够导电,部分电离,属于弱电解质;
②浓硫酸(98%)是混合物,不含自由电子或者自由移动离子,不导电,属于混合物,既不是电解质,也不是非电解质;
③熔融的AlCl3是共价化合物,不含自由电子或者自由移动离子,不导电,水溶液中能完全电离,属于强电解质;
④液态SO3,不含自由电子或者自由移动离子,不导电,本身不能电离产生自由移动离子,属于非电解质;
⑤葡萄糖固体,不含自由电子或者自由移动离子,不导电,在水溶液里和熔融状态下都不能导电的化合物,属于非电解质;
⑥石墨含有自由移动电子,能导电,属于单质,既不是电解质,也不是非电解质;
⑦亚硫酸不含自由电子或者自由移动离子,不导电,水溶液中部分电离,属于电解质中的弱电解质;
⑧水玻璃是硅酸钠的水溶液,含有自由移动离子,能导电,是混合物,既不是电解质,也不是非电解质;
⑨盐酸含有自由移动离子,能导电,是混合物,既不是电解质,也不是非电解质;
⑩KAl(SO4)2•12H2O不含自由电子或者自由移动离子,不导电,水溶液中能完全电离,属于电解质中的强电解质;
⑪氨水含有自由移动离子,能导电,属于混合物,既不是电解质,也不是非电解质;
所以:(1)能导电的是①⑥⑧⑨⑪;
(2)属于电解质的是①③⑦⑩;
(3)属于非电解质的是④⑤;
(4)属于强电解质的是⑩;
故答案为:①⑥⑧⑨⑪;①③⑦⑩;④⑤;⑩.
点评 本题考查了电解质、非电解质、强电解质的判断,熟悉相关概念是解题关键,注意单质、混合物既不是电解质也不是非电解质,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
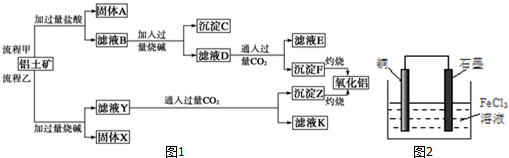
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液:Cu2+、Al3+、NO3-、SO42- | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 8g H2O在标准状况下的体积是22.4L | |
| C. | 2.4g金属镁变为镁离子时失去的电子数为NA | |
| D. | 17g氨气所含电子数目为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2 NH4Cl Fe2(SO4)3 NaNO3 | |
| B. | (NH4)2SO4 CuSO4 Na2CO3 FeCl3 | |
| C. | Cu(NO3)2 NH4 NO3 FeCl3 H2S | |
| D. | Ba Cl2 Cu(NO3)2 (NH4)2SO4 Fe (NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
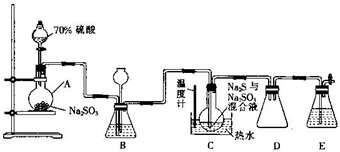 Na2S2O3•5H2O俗称:“海波”,是常用的定影剂和还原剂,它是无色晶体,易溶于水,不溶于乙醇,遇酸易分解:S2O32-+2H+=S↓+SO2↑+H2O,在20℃和70℃时的溶解度分别为60.0g和212.0g,Na2S2O3•5H2O在40~50℃时会熔化,48℃时会分解,工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如图所示的装置(略去部分夹持仪器)模拟生成过程.
Na2S2O3•5H2O俗称:“海波”,是常用的定影剂和还原剂,它是无色晶体,易溶于水,不溶于乙醇,遇酸易分解:S2O32-+2H+=S↓+SO2↑+H2O,在20℃和70℃时的溶解度分别为60.0g和212.0g,Na2S2O3•5H2O在40~50℃时会熔化,48℃时会分解,工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如图所示的装置(略去部分夹持仪器)模拟生成过程.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
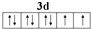 ,写出A、B形成化合物的电子式
,写出A、B形成化合物的电子式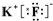
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BF3是三角锥形分子 | |
| B. | NH4+的电子式: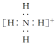 ,离子呈平面形结构 ,离子呈平面形结构 | |
| C. | CO2的分子模型示意图: | |
| D. | CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s-sp3σ键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com