
 2HI(g)。已知H2和I2的起始浓度均为0.10 mol/L,达到平衡时HI的浓度为0.16 mol/L,若H2和I2的起始浓度均为0.20 mol/L,则平衡时H2的浓度(mol/L)是
2HI(g)。已知H2和I2的起始浓度均为0.10 mol/L,达到平衡时HI的浓度为0.16 mol/L,若H2和I2的起始浓度均为0.20 mol/L,则平衡时H2的浓度(mol/L)是| A.0.32 | B.0.16 | C.0.08 | D.0.04 |
科目:高中化学 来源:不详 题型:单选题
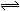 2C(g) △H>0。下列反应条件有利于生成C的是( )
2C(g) △H>0。下列反应条件有利于生成C的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

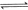
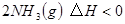 ,工业上选择的适宜条件为:
,工业上选择的适宜条件为: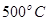 、铁作催化剂、
、铁作催化剂、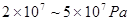 。下列说法正确的是
。下列说法正确的是| A.升高温度既加快反应速率,又有利于平衡向合成氨方向移动 |
| B.铁作催化剂既加快反应速率,又有利于平衡向合成氨方向移动 |
| C.增大压强既加快反应速率,又有利于平衡向合成氨方向移动 |
| D.将氨分离出来,既加快反应速率,又有利于平衡向合成氨方向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g),下列操作能增大反应速率并使平衡右移的是( )
2SO3(g),下列操作能增大反应速率并使平衡右移的是( )| A.降低体系温度 | B.增大体系容积 | C.移去SO3 | D.通入O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.缩小反应容器体积 | B.通入CO2 |
| C.升高温度到900℃ | D.使用合适的催化剂 |
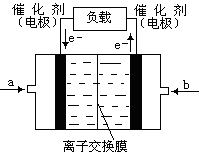
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
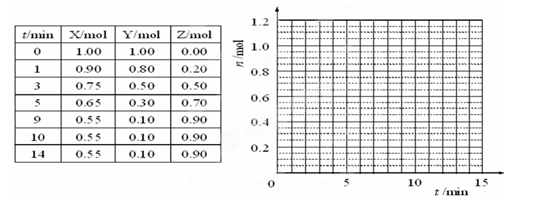
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(气)+H2(气); CO(气)+H2O(气)
CO(气)+H2(气); CO(气)+H2O(气) 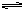 CO2(气)+H2(气) 当反应达到平衡时,测得c(H2)=1.9mol/L,c(CO)=0.1mol/L,则CO2的浓度为( )
CO2(气)+H2(气) 当反应达到平衡时,测得c(H2)=1.9mol/L,c(CO)=0.1mol/L,则CO2的浓度为( )| A.0.1mol/L | B.0.9mol/L | C.1.8mol/L | D.1.9mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 C6H5CH=CH2(g)+H2 (g) ?△H=+125kJ·mol-1
C6H5CH=CH2(g)+H2 (g) ?△H=+125kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com