
【题目】关于下列图示的说法中正确的是( ) 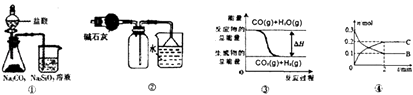
A.由图①所示实验可得出三种元素的非金属性强弱顺序是:氯>碳>硅
B.图②可用于干燥、收集氯化氢,并吸收多余的氯化氢
C.图③表示可逆反应CO(g)+H2O(g)CO2(g)+H2(g)的△H>0
D.对反应:A(s)+2B(g)xC(g),根据图④可以求出x=2
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】一种充电电池放电时的电极反应为:H2+2OH﹣﹣2e﹣=2H2O;NiO(OH)+H2O+e﹣=Ni(OH)2+OH﹣当为电池充电时,与外电源正极连接的电极上发生的反应是( )
A.H2O的还原
B.NiO(OH)的还原
C.H2的氧化
D.Ni(OH)2的氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度为0.1mol/L、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图回答下列问题:
(1)该温度时氨水的电离平衡常数K= .
(2)比较b、c、d三点时的溶液中,水电离 的c(OH﹣)大小顺序为 .
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有 .
A.c(H+)c(OH﹣)
B.![]()
C.![]()
D.![]()
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和 NH3H2O两种形式) .
A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3H2O)+c(OH﹣)
B.点 c所示溶液中:c(Cl﹣)=c(NH3H2O)+c(NH4+)
C.点 d所示溶液中:c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣)
D.滴定中可能有:c(NH3H2O)>c(NH4+)>c(OH﹣)>c(Cl﹣)>c(H+)
(5)滴定过程中所用盐酸的pH= , d点之后若继续加入盐酸至图象中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知1mol单质碳完全燃烧放出热量为Y kJ,则1molC与O2反应生成CO的热量变化为
A.放出Y kJ B.放出(5X-5Y) kJ
C.放出(10X-Y) kJ D.吸收(10X-Y) kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCL2俗名作光气,是有毒气体.在一定条件下,可发生的化学反应为:COCL2(g) ![]() CO(g)+CL2(g)△H<0.下列有关说法正确的是( )
CO(g)+CL2(g)△H<0.下列有关说法正确的是( )
A.在一定条件下,使用催化剂能加快反应速率并提高反应物的平转化率
B.当反应达平衡时,恒温恒压条件下通人Ar,能提高COCl2的转化率
C.单位时间内生成CO和CL2的物质的量比为1:1时,反应达到平衡状态
D.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中 Cl- 、Br- 、I - 三者物质的量之比为1∶2∶3,通入一定量的氯气,当反应后,该比值为3∶2∶1,则反应的氯气和原溶液中I-的物质的量之比为
A.3∶2B.2∶3C.1∶2D.1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)乙烯的电子式为____________________;
(2)写出B中官能团的名称:____________;D中官能团的名称:____________。
(3)写出下列反应的化学方程式并注明反应类型:
①___________________________;反应类型_____________;
②___________________________;反应类型_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有着重要的应用.请按要求写出相应的方程式.
(1)将含SO2的废气通入含Fe2+(催化剂)的溶液中,常温下可使SO2转化为SO24﹣ , 其总反应为2SO2+O2+2H2O=2H2SO4 . 上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: .
(2)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6﹣2x]溶液.若溶液的pH偏高,则碱式硫酸铝产率降低且有气泡产生,用化学方程式表示其原因: .
(3)ClO2是一种高效安全的杀菌消毒剂.氯化钠电解法生产ClO2工艺原理示意图如下: 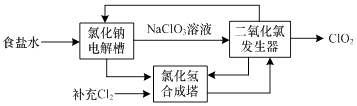
①写出氯化钠电解槽内发生反应的离子方程式: .
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目: .
③ClO2能将电镀废水中的CN﹣离子氧化成两种无毒气体,自身被还原成Cl﹣ . 写出该反应的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com