
ЁОЬтФПЁПдк2LУмБеШнЦїжаЃЌ800ЁцЪБЗДгІ2NOЃЈgЃЉЃЋO2ЃЈgЃЉ![]() 2NO2ЃЈgЃЉЬхЯЕжаЃЌnЃЈNOЃЉЫцЪБМфЕФБфЛЏШчБэЃК
2NO2ЃЈgЃЉЬхЯЕжаЃЌnЃЈNOЃЉЫцЪБМфЕФБфЛЏШчБэЃК

ЃЈ1ЃЉЩЯЪіЗДгІ________ЃЈЬюЁАЪЧЁБЛђЁАВЛЪЧЁБЃЉПЩФцЗДгІЁЃ
ЃЈ2ЃЉШчЭМЫљЪОЃЌБэЪОNO2БфЛЏЧњЯпЕФЪЧ ________ЁЃгУO2БэЪОДг0ЁЋ2 sФкИУЗДгІЕФЦНОљЫйТЪvЃН________ЁЃ
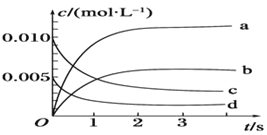
ЃЈ3ЃЉФмЫЕУїИУЗДгІвбДяЕНЦНКтзДЬЌЕФЪЧ_______ЃЈЬюађКХЃЉЁЃ
aЃЎvЃЈNO2ЃЉЃН2vЃЈO2ЃЉ bЃЎШнЦїФкбЙЧПБЃГжВЛБф
cЃЎvФцЃЈNOЃЉЃН2vе§ЃЈO2ЃЉ dЃЎШнЦїФкУмЖШБЃГжВЛБф
ЁОД№АИЁПЃЈ1ЃЉЪЧ
ЃЈ2ЃЉbЃЛvЃН1.5ЁС10Ѓ3molЁЄЃЈLЁЄsЃЉЃ1
ЃЈ3ЃЉbc
ЁОНтЮіЁП
ЪдЬтЗжЮіЃКЃЈ1ЃЉИљОнБэжаЪ§ОнПЩжЊЃЌ3sЪБNOЮЊ0.007molЃЌЧвВЛдйЫцзХЪБМфЕФЭЦвЦЖјМѕаЁЃЌЫљвдЗДгІВЛФмЭъШЋНјааЃЌЫљвдИУЗДгІЪЧПЩФцЗДгІЁЃ
ЙЪД№АИЮЊЃКЪЧЃЛ
ЃЈ2ЃЉNO2ЪЧВњЮяЃЌЫцЗДгІНјааХЈЖШдіДѓЃЌгЩЗНГЬЪНПЩжЊЦНКтЪБЁїcЃЈNO2ЃЉ=ЁїcЃЈNOЃЉ= ![]() =0.0065mol/LЃЌЫљвдЭМжаБэЪОNO2БфЛЏЕФЧњЯпЪЧbЃЌ2sФкгУNOБэЪОЕФЦНОљЗДгІЫйТЪvЃЈNOЃЉ=
=0.0065mol/LЃЌЫљвдЭМжаБэЪОNO2БфЛЏЕФЧњЯпЪЧbЃЌ2sФкгУNOБэЪОЕФЦНОљЗДгІЫйТЪvЃЈNOЃЉ= =3.0ЁС10-3molL-1s-1ЃЌЫйТЪжЎБШЕШгкЛЏбЇМЦСПЪ§жЎБШЃЌЫљвдvЃЈO2ЃЉ=
=3.0ЁС10-3molL-1s-1ЃЌЫйТЪжЎБШЕШгкЛЏбЇМЦСПЪ§жЎБШЃЌЫљвдvЃЈO2ЃЉ=![]() vЃЈNOЃЉ=
vЃЈNOЃЉ=![]() ЁС3.0ЁС10-3molL-1s-1=1.5ЁС10-3molL-1s-1ЁЃ
ЁС3.0ЁС10-3molL-1s-1=1.5ЁС10-3molL-1s-1ЁЃ
ЙЪД№АИЮЊЃКbЃЛ1.5ЁС10-3molL-1s-1ЃЛ
ЃЈ3ЃЉaЃЎШєЗДгІДяЕНЦНКтЃЌдђv(NO2)е§=2v(O2)ФцЃЌЯждкЫйТЪЕФе§ЁЂФцЮДжИУїЃЌвђДЫВЛФмХаЖЯЗДгІЪЧЗёДяЕНЦНКтЃЌЙЪaДэЮѓЃЛbЃЎгЩгкИУЗДгІЪЧЗДгІЧАКѓЦјЬхЬхЛ§ВЛЕШЕФЗДгІЃЌЫљвдШєШнЦїФкбЙЧПБЃГжВЛБфЃЌдђЗДгІДяЕНЦНКтЃЌЙЪbе§ШЗЃЛcЃЎvФц(NO)=2vе§(O2)ЃЌдђNOЁЂO2ЕФХЈЖШВЛБфЃЌЗДгІДяЕНЦНКтЃЌЙЪcе§ШЗЃЛdЃЎЦјЬхЕФзмжЪСПВЛБфЃЌШнЦїШнЛ§ВЛБфЃЌЫљвдШнЦїФкУмЖШЪМжеБЃГжВЛБфЃЌвђДЫВЛФмХаЖЯЗДгІЪЧЗёДяЕНЦНКтЃЌЙЪdДэЮѓЁЃ
ЙЪД№АИЮЊЃКbcЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙигкЮяжЪЗжРрЕФЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
AЃЎИљОнВЛЭЌЕФЗжРрБъзМЃЌПЩНЋбЮЫсЙщРрЮЊДПОЛЮяЁЂвЛдЊЫсЁЂЧПЕчНтжЪ
BЃЎЬЧРрЁЂгЭжЌЁЂЕААзжЪЖМЪєгкЬьШЛИпЗжзгЛЏКЯЮя
CЃЎИљОнЫсЗжзгжаКЌгаЕФЧтдзгИіЪ§ЃЌНЋЫсЗжЮЊвЛдЊЫсЁЂЖўдЊЫсКЭЖрдЊЫс
DЃЎЮяжЪЕФЗжНтЁЂЫЎНтЁЂСбНтЁЂЕчНтОљЪєгкГЃМћЕФЛЏбЇБфЛЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪжаВЛЪєгкгЭжЌЕФЪЧЃЈ ЃЉ
ЂйЛЈЩњгЭ ЂкШѓЛЌгЭ ЂлИЪгЭ ЂмУозбгЭ ЂнХЃгЭ ЂоЦћгЭ
AЃЎЂйЂк BЃЎЂкЂлЂо CЃЎЂлЂм DЃЎЂкЂнЂо
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЭЪЧЩњЮяЬхБиашЕФЮЂСПдЊЫиЃЌвВЪЧШЫРрзюдчЪЙгУЕФН№ЪєжЎвЛЁЃЭЕФЩњВњКЭЪЙгУЖдЙњМЦУёЩњИїИіЗНУцЖМВњЩњСЫЩюдЖЕФгАЯьЁЃ
ЃЈ1ЃЉаДГіЭгыЯЁЯѕЫсЗДгІЕФЛЏбЇЗНГЬЪНЃК ЁЃ
ЃЈ2ЃЉЮЊСЫБЃЛЄЛЗОГКЭНкдМзЪдДЃЌЭЈГЃЯШгУH2O2КЭЯЁСђЫсЕФЛьКЯШмвКШмГіЗЯОЩгЁЫЂЕчТЗАхжаЕФЭЃЌзюжеЪЕЯжЭЕФЛиЪеРћгУЁЃаДГіШмГіЭЕФРызгЗНГЬЪНЃК ЁЃ
ЃЈ3ЃЉЙЄвЕЩЯвдЛЦЭПѓЮЊдСЯЃЌВЩгУЛ№ЗЈШлСЖЙЄвеЩњВњЭЁЃИУЙЄвеЕФжаМфЙ§ГЬЛсЗЂЩњЗДгІЃК2Cu2OЃЋCu2S![]() 6CuЃЋSO2ЃЌИУЗДгІЕФЛЙдМСЪЧ ЃЛЕБЩњГЩ19.2 g CuЪБЃЌЗДгІжазЊвЦЕФЕчзгЮЊ molЁЃ
6CuЃЋSO2ЃЌИУЗДгІЕФЛЙдМСЪЧ ЃЛЕБЩњГЩ19.2 g CuЪБЃЌЗДгІжазЊвЦЕФЕчзгЮЊ molЁЃ
ЃЈ4ЃЉЭдкГБЪЊЕФПеЦјжаФмЗЂЩњЮќбѕИЏЪДЖјЩњатЃЌЭатЕФжївЊГЩЗжЮЊCu2(OH)2CO3(МюЪНЬМЫсЭ)ЁЃЪдаДГіЩЯЪіЙ§ГЬжаИКМЋЕФЕчМЋЗДгІЪНЃК ЁЃ
ЃЈ5ЃЉбаОПадбЇЯАаЁзщгУЁАМфНгЕтСПЗЈЁБВтЖЈФГЪдбљжаCuSO4ЁЄ5H2O(ВЛКЌФмгыIЃЗДгІЕФбѕЛЏаддгжЪ)ЕФКЌСПЁЃШЁa gЪдбљХфГЩ100 mLШмвКЃЌУПДЮШЁ25.00 mLЃЌЕЮМгKIШмвККѓгаАзЩЋЕтЛЏЮяГСЕэЩњГЩЁЃаДГіИУЗДгІЕФРызгЗНГЬЪНЃК ЁЃМЬајЕЮМгKIШмвКжСГСЕэВЛдйВњЩњЃЌШмвКжаЕФI2гУСђДњСђЫсФЦБъзМШмвКЕЮЖЈЃЌЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊI2ЃЋ2Na2S2O3===2NaIЃЋNa2S4O6ЃЌЦНОљЯћКФc mol/LЕФNa2S2O3ШмвКV mLЁЃдђЪдбљжаCuSO4ЁЄ5H2OЕФжЪСПЗжЪ§ЮЊ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГKClбљЦЗжаКЌгаЩйСПK2CO3ЁЂK2SO4КЭВЛШмгкЫЎЕФдгжЪЁЃЮЊСЫЬсДПKClЃЌЯШНЋбљЦЗШмгкЪЪСПЫЎжаЃЌНСАшЁЂЙ§ЬВЃЌдйНЋСАвКАДЯТЭМЫљЪОВНЗНјааЬсДП(Й§САВйзївбТдШЅ)ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ

AЃЎ Ц№ЪМТЫвКГЃЮТЯТpH=7
BЃЎЪдМСЂёЮЊBa(NO3)2ШмвК
CЃЎЩЯЭМЙ§ГЬаыО2ДЮЙ§ТЫ
DЃЎВНжшЂлФПЕФЪЧГ§ШЅ CO32Љ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквдРызгМќЮЊжїЕФЛЏбЇМќжаГЃКЌгаЙВМлМќЕФГЩЗжЃЎЯТСаИїЖддзгаЮГЩЛЏбЇМќжаЙВМлМќГЩЗжзюЩйЕФЪЧЃЈ ЃЉ
AЃЎLiЃЌF BЃЎNaЃЌF CЃЎNaЃЌC1 DЃЎMgЃЌO
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТБэЮЊдЊЫижмЦкБэЕФвЛВПЗжЁЃ
ЬМ | ЕЊ | Y | |
X | Сђ | Z |
ЛиД№ЯТСаЮЪЬт
ЃЈ1ЃЉZдЊЫидкжмЦкБэжаЕФЮЛжУЮЊ__________ЁЃ
ЃЈ2ЃЉБэжадЊЫидзгАыОЖзюДѓЕФЪЧЃЈаЛдЊЫиЗћКХЃЉ__________ЁЃ
ЃЈ3ЃЉЯТСаЪТЪЕФмЫЕУїYдЊЫиЕФЗЧН№ЪєадБШSдЊЫиЕФЗЧН№ЪєадЧПЕФЪЧ__________ЃЛ
aЃЎYЕЅжЪгыH2SШмвКЗДгІЃЌШмвКБфЛызЧ
bЃЎдкбѕЛЏЛЙдЗДгІжаЃЌ1molYЕЅжЪБШ1molSЕУЕчзгЖр
cЃЎYКЭSСНдЊЫиЕФМђЕЅЧтЛЏЮяЪмШШЗжНтЃЌЧАепЕФЗжНтЮТЖШИп
ЃЈ4ЃЉXгыZСНдЊЫиЕФЕЅжЪЗДгІЩњГЩ1molXЕФзюИпМлЛЏКЯЮяЃЌЛжИДжСЪвЮТЃЌЗХШШ687kJЃЌвбжЊИУЛЏКЯЮяЕФШлЁЂЗаЕуЗжБ№ЮЊ-69ЁцКЭ58ЁцЃЌаДГіИУЗДгІЕФШШЛЏбЇЗНГЬЪН__________ЁЃ
ЃЈ5ЃЉЬМгыУОаЮГЩЕФ1molЛЏКЯЮяQгыЫЎЗДгІЃЌЩњГЩ2molMgЃЈOHЃЉ2КЭ1molЬўЃЌИУЬўЗжзгжаЬМЧтжЪСПБШЮЊ9:1ЃЌЬўЕФЕчзгЪНЮЊ__________ЁЃQгыЫЎЗДгІЕФЛЏбЇЗНГЬЪНЮЊ__________ЁЃ
ЃЈ6ЃЉЭгывЛЖЈХЈЖШЕФЯѕЫсКЭСђЫсЕФЛьКЯЫсЗДгІЃЌЩњГЩЕФбЮжЛгаСђЫсЭЃЌЭЌЪБЩњГЩЕФСНжжЦјЬхОљгЩБэжаСНжжЦјЬхзщГЩЃЌЦјЬхЕФЯрЖдЗжзгжЪСПЖМаЁгк50ЁЃЮЊЗРжЙЮлШОЃЌНЋВњЩњЕФЦјЬхЭъШЋзЊЛЏЮЊзюИпМлКЌбѕЫсбЮЃЌЯћКФ1L2.2mol/LNaOHШмвККЭ1molO2ЃЌдђСНжжЦјЬхЕФЗжзгЪНМАЮяжЪЕФСПЗжБ№ЮЊ__________ЃЌЩњГЩСђЫсЭЮяжЪЕФСПЮЊ__________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПNa2CO3ЕФжЦШЁЗНЗЈМАзлКЯЪЕбщЬНОП
ЃЈ1ЃЉЮвЙњЛЏбЇМвКюЕТАёИФИяЙњЭтЕФДПМюЩњВњЙЄвеЃЌЦфЩњВњСїГЬПЩМђвЊБэЪОШчЯТЃК

ЂйЭљБЅКЭЪГбЮЫЎжавРДЮЭЈШызуСПЕФNH3ЁЂCO2(АБМюЗЈ)ЃЌЖјВЛЯШЭЈCO2дйЭЈNH3ЕФдвђЪЧ________________________ЁЃ
ЂкДгЩњВњСїГЬЭМПЩжЊЃЌПЩбЛЗРћгУЕФЮяжЪЪЧ_____________ЁЃ
ЂлаДГіГСЕэГижаЁЂьбЩеТЏжаЗДгІЕФЛЏбЇЗНГЬЪН__________________ЁЃ
ЃЈ2ЃЉШчКЮгУCO2КЭ50 mL 2 molЁЄLЃ1 NaOHШмвКжЦШЁ50 mL 1 molЁЄLЃ1 Na2CO3ШмвКЃП
ЂйаДГіМђвЊЕФЪЕбщВНжшЃК_________________________________ЁЃ
ЂкаДГігаЙиЗДгІЕФЛЏбЇЗНГЬЪНЃК___________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПH2C2O4ЮЊЖўдЊШѕЫсЁЃ20ЁцЪБЃЌХфжЦвЛзщcЃЈH2C2O4ЃЉ+ cЃЈHC2O4-ЃЉ+ cЃЈC2O42-ЃЉ=0.100 molЁЄL-1ЕФH2C2O4КЭNaOHЛьКЯШмвКЃЌШмвКжаВПЗжЮЂСЃЕФЮяжЪЕФСПХЈЖШЫцpHЕФБфЛЏЧњЯпШчгвЭМЫљЪОЁЃЯТСажИЖЈШмвКжаЮЂСЃЕФЮяжЪЕФСПХЈЖШЙиЯЕвЛЖЈе§ШЗЕФЪЧЃЈ ЃЉ

AЃЎpH=2.5ЕФШмвКжаЃКcЃЈH2C2O4ЃЉ+cЃЈC2O42-ЃЉЃОcЃЈHC2O4-ЃЉ
BЃЎcЃЈNa+ЃЉЃН0.100 molЁЄL-1ЕФШмвКжаЃКcЃЈH+ЃЉ+cЃЈH2C2O4ЃЉЃНcЃЈOH-ЃЉ+cЃЈC2O42-ЃЉ
CЃЎcЃЈHC2O4-ЃЉЃНcЃЈC2O42-ЃЉЕФШмвКжаЃКcЃЈNa+ЃЉЃО0.100 molЁЄL-1+cЃЈHC2O4-ЃЉ
DЃЎpH=7ЕФШмвКжаЃКcЃЈNa+ЃЉЃО2cЃЈC2O42-ЃЉ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com