
【题目】现有甲、乙、丙、丁四种常见化合物,它们分别由H+、Na+、Al3+、Ba2+、OH-、Cl-、SO42-、HCO3-中的两种离子(离子不重复)组成,可以发生如图所示的转化。
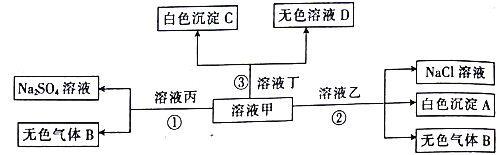
回答下列问题:
(1)写出下列物质的化学式:甲______,乙______,丁______,A______ C______。
(2)向丙溶液中滴入Fe(NO3)2溶液时发生反应的离子方程式为_______。
【答案】 NaHCO3 AlCl3 Ba(OH)2 Al(OH)3 BaCO3 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
【解析】(1)甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、SO42-、HCO3-离子中的两种组成。甲溶液和乙溶液生成硫酸钠和气体、甲溶液和丙溶液NaCl和沉淀、气体,甲为Na HCO3,乙是硫酸,丙为AlCl3,丁为Ba(OH)2,A为Al(OH)3,C是BaCO3,由于物质的用量不确定,则D为NaOH或碳酸钠。
(2)向丙溶液中滴入Fe(NO3)2溶液时发生反应的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法中,正确的是
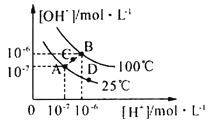
A.图中A、B、D三点处Kw的大小关系:B>A>D
B.25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3·H2O)的值逐渐减小
C.在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点
D.A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:第一,有氧气生成;第二,_____________________________。 过氧化钠跟水反应的化学方程式为_______________。
(2)某研究性学习小组拟用如图所示装置进行实验,以证明上述结论。用以验证第一条结论的实验方法和现象是_______________。用以验证第二条结论的实验方法及现象是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题:

(1)铜钱在我国历史上曾经是一种广泛流通的货币,铜常用于制造货币的原因可能是________(填序号)。
A. 铜的熔点不是太高,易于冶炼,铸造成型
B. 铜的性质不活泼,不易被腐蚀
C. 我国较早的掌握了湿法冶炼铜的技术
D. 自然界有大量的游离态的铜
(2)钢铁制品的使用更为广泛,但是铁制品易生锈,铁锈的主要成分是____________(填名称),铁的氧化物常见的还有_____________、___________(填化学式)。
(3)铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸碱破坏,若使氧化铝与氧氧化钠溶液作用,反应的离子方程式为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用下列装置探究氯气与氨气的反应.其中A、B分别为氯气和氨气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
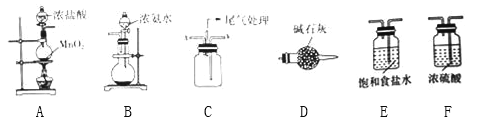
(1)若Cl2从左向右流动,NH3从右向左流动,则上述实验装置中,依次连接的合理顺序为:A→________________→B;为使NH3与Cl2更充分混合,Cl2应从C装置的__口进入(填“x”或“y”).
(2)简述装置A中使用分液漏斗向圆底烧瓶中滴加浓盐酸的操作是__________________.
(3)装置A中发生反应的离子方程式为_______________________________.
(4)装置B中圆底烧瓶内的试剂为______________(填名称).
(5)装置D的作用是____________________________.
(6)反应开始后,装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气中的主要成分之一,该反应的化学方程式为________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种金属组成的合金A,在合适的条件下可按下图进行反应(部分产物和水省略),已知F为红褐色沉淀,请回答:
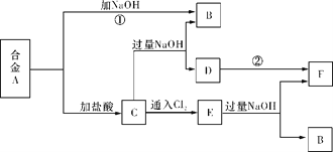
(1)溶液C的溶质主要是____________________(填化学式)。
(2)写出反应②的化学方程式_______________________________________________。描述D变F的实验现象_______________________________________________。
(3)写出反应C→E的离子方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种元素的原子序数依次递增。已知:①
五种元素的原子序数依次递增。已知:①![]() 位于周期表中第四周期
位于周期表中第四周期![]() 族,其余的均为短周期主族元素:②
族,其余的均为短周期主族元素:②![]() 的氧化物是光导纤维的主要成分;③
的氧化物是光导纤维的主要成分;③![]() 原子核外
原子核外![]() 层电子数为奇数;④
层电子数为奇数;④![]() 是形成化合物种类最多的元素;⑤
是形成化合物种类最多的元素;⑤![]() 原子
原子![]() 轨道的电子数为4。请回答下列问题:
轨道的电子数为4。请回答下列问题:
(1)写出一种![]() 元素形成氢化物的化学式_____________。
元素形成氢化物的化学式_____________。
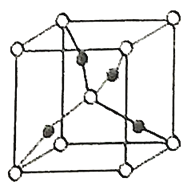
(2)在1个由![]() 与
与![]() 形成的
形成的![]() 晶胞中(结构如图所示)所包含的
晶胞中(结构如图所示)所包含的![]() 原子数目为____________个。
原子数目为____________个。
(3)在[F(NH3)4]2+离子中,![]() 的空轨道接受
的空轨道接受![]() 的氮原子提供的__________形成配位键。
的氮原子提供的__________形成配位键。
(4)常温下![]() 、
、![]() 和氢元素按原子数目1:1:2形成的气态常见物质
和氢元素按原子数目1:1:2形成的气态常见物质![]() 是__________(写名称),
是__________(写名称),![]() 物质分子中
物质分子中![]() 原子轨道的杂化类型为__________,
原子轨道的杂化类型为__________,![]() 分子中
分子中![]() 键的数目为__________
键的数目为__________![]() 。
。
(5)![]() 、
、![]() 、
、![]() 三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
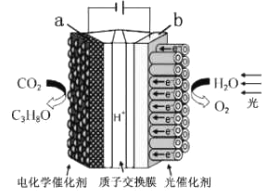
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1 mol O2,有44 gCO2被还原
D. a电极的反应为:3CO2+ 16H+-18e-= C3H8O+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com