
【题目】有相对原子质量均大于10的A、B两种元素,原子核内质子数等于中子数。它们能形成气态化合物X和Y。已知等物质的量的X和Y的混合物的密度是同条件下氢气密度的18.5倍,其中X和Y的质量比为3:4.4,经测定X的组成为AB,Y的组成为AnB,试通过计算确定:A、B各是什么元素______________?写出X、Y的化学式______________。
【答案】A、B应分别为N元素和O元素 X、Y分别为NO和N2O
【解析】
根据气体阿伏伽德罗定律的推论可知已知等物质的量的X和Y的混合物的相对分子质量是18.5×2=37,已知X与Y的质量比为可以推知X与Y的相对分子质量之比,解方程可得答案。
由等物质的量的X和Y混合的气体其密度是相同条件下氢气的18.5倍可知x,y混合气体的相对分子量为18.5×2=37;等物质的量的X和Y的混合物中,X与Y的质量比为3:4.4 ,由M=![]() 可知相对分子质量之比为3:4.4,又因为等物质量X和Y混合气体的平均相对分子量为37,所以X和Y的相对分子质量之和为37×2=74,可以知道X的分子量为30, y的分子量为44,由A+B=30 A×n+ B=44可知(n-1)×A=14,且n和A为整数,所以得到n=2;A=14;B=16。所以A为7号原子,B为8号原子,即A是N, B是O ,X是NO ,Y是N2O。故答案为:A、B应分别为N元素和O元素;X、Y分别为NO和N2O。
可知相对分子质量之比为3:4.4,又因为等物质量X和Y混合气体的平均相对分子量为37,所以X和Y的相对分子质量之和为37×2=74,可以知道X的分子量为30, y的分子量为44,由A+B=30 A×n+ B=44可知(n-1)×A=14,且n和A为整数,所以得到n=2;A=14;B=16。所以A为7号原子,B为8号原子,即A是N, B是O ,X是NO ,Y是N2O。故答案为:A、B应分别为N元素和O元素;X、Y分别为NO和N2O。


科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入 1 mol X 与 2 mol Y 发生反应:X(g)+2Y(g) ![]() aZ(g) H<0,达到平衡后,改变某一条件(温度或容器体积),X 的平衡转化率的变化如图所示。下列说法中正确的是( )
aZ(g) H<0,达到平衡后,改变某一条件(温度或容器体积),X 的平衡转化率的变化如图所示。下列说法中正确的是( )
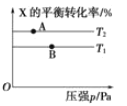
A.a=2
B.T2>T1
C.A 点的反应速率:3v 正(X)=v 逆(Z)
D.用 Y 表示 A、B 两点的反应速率:v(A)>v(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
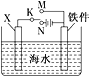
利用如图装置,可以模拟铁的电化学防护。
①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为N2O与CO2分子具有相似的结构(包括电子式);又已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为__________,由此可知它______________ (填“含有”或“不含”)非极性键。
(2)长期以来一直认为氟的含氧酸不存在。自1971年美国科学家用F2通过细冰末获得HFO(次氟酸)以来,对HFO的研究引起重视。
①HFO的电子式为_______________________,写出HFO的结构式,并标出HFO中各元素的化合价_________________________。
②次氟酸的名称是否妥当?为什么?___________________________________________。
③次氟酸能与水反应生成两种物质,其中有一种物质常用于雕刻玻璃,试写出次氟酸与水反应的化学方程式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
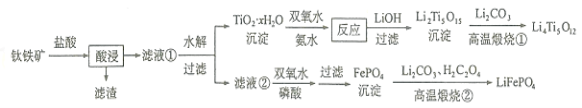
回答下列问题:
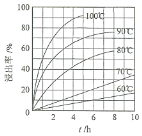
(1) “酸浸”实验中,铁的浸出率结果如图所示。由图可知:当铁的浸出率为70%时,所采用的实验条件为____________________。
(2) “酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率 | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因_____________________。
(4)Li2Ti5O15中Ti的化合价为![]() ,其中过氧键的数目为______________。
,其中过氧键的数目为______________。
(5)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了核电荷数为21~25的元素的最高正化合价,回答下列问题:
元素名称 | 钪 | 钛 | 钒 | 铬 | 锰 |
元素符号 | Sc | Ti | V | Cr | Mn |
核电荷数 | 21 | 22 | 23 | 24 | 25 |
最高正价 | +3 | +4 | +5 | +6 | +7 |
(1) 按要求完成填充:
①Sc的价电子排布___________________________________________________________ ;
②Ti外围电子排布____________________________________________________________;
③用“原子实”表示V的核外电子排布___________________________________________;
④ 用轨道表示式表示Mn的特征电子排布 _______________________________________。
(2)已知基态铬原子的电子排布是1s22s22p63s23p63d54s1,并不符合构造原理。人们常常会碰到客观事实与理论不相吻合的问题,当你遇到这样的问题时,你的态度是_________________________。
(3)对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是_____出现这一现象的原因是________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①![]()
②![]()
③![]()
则下列叙述正确的是
A.由上述热化学方程式可知![]()
B.甲烷的燃烧热为![]()
C.![]()
![]()
D.若甲醇和甲烷的物质的量之比为![]() ,其完全燃烧生成
,其完全燃烧生成![]() 和
和![]() 时放出的热量为
时放出的热量为![]() ,则该混合物中甲醇的物质的量为
,则该混合物中甲醇的物质的量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,回答下列小题。
铁放置时间长了就会生锈。铁容易生锈,除了由于它的化学性质活泼以外,同时与外界条件也有很大关系。水分是使铁容易生锈的物质之一。然而,光有水也不会使铁生锈,只有当空气中的氧气溶解在水里时,氧在有水的环境中与铁反应,才会生成一种叫氧化铁的东西,这就是铁锈,铁生锈总的反应为4Fe+3O2+xH2O![]() 2Fe2O3·xH2O。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。
2Fe2O3·xH2O。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。
【1】铁生锈总反应属于 ( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
【2】关于反应4Fe(OH)2+O2+2H2O![]() 4Fe(OH)3,下列说法正确的是 ( )
4Fe(OH)3,下列说法正确的是 ( )
A.O2发生还原反应
B.Fe(OH)2被还原
C.H2O发生氧化反应
D.H2O是氧化剂
【3】下列反应条件的改变对4Fe+3O2+xH2O![]() 2Fe2O3·xH2O速率的影响不正确的是( )
2Fe2O3·xH2O速率的影响不正确的是( )
A.增大O2的浓度能加快生锈速率
B.潮湿环境中铁生锈的速率更快
C.升高温度能加快生锈速率
D.干燥空气中铁生锈速率更快
【4】下列反应吸收热量的是 ( )
A.铁与稀盐酸反应
B.铁丝在氧气中燃烧
C.铝还原氧化铁
D.碳与二氧化碳反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com