
【题目】如图为周期表中部分元素某种性质(X值)随原子序数变化的关系。
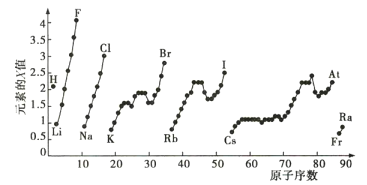
(1)短周期中原子核外p能级上电子数与s能级上电子总数相等的元素是___(填元素符号)。
(2)同主族内不同元素的X值变化的特点是___;同周期内,随着原子序数的增大,X值的变化总趋势是___。周期表中X值的这种变化特点体现了元素性质的___变化规律。
(3)X值较小的元素集中在元素周期表的___(填序号,下同)。
a.左下角 b.右上角 c.分界线附近
(4)下列说法正确的是___。
a.X值可反映元素最高正化合价的变化规律
b.X值可反映原子在分子中吸引电子的能力
c.X值的大小可用来衡量元素金属性和非金属性的强弱
【答案】O、Mg 同主族元素从上到下,元素的X值逐渐减小 增大 周期性 a bc
【解析】
(1)由于p能级最多容纳6个电子,s能级最多容纳2个电子,因此短周期中原子核外p能级上电子数与s能级上电子总数相等的元素的核外电子排布为1s22s22p4、1s22s22p63s2,即分别为O和Mg;
(2)如图所示,可得同主族内不同元素的X值变化的特点是同一主族元素,从上到下,X值逐渐减小;同周期内,随着原子序数的增大,X值逐渐增大;周期表中X值的这种变化特点体现了元素性质的周期性变化规律;
(3)根据同一主族元素,从上到下,X值逐渐减小,同周期内,从左到右,X值逐渐增大,所以X值较小的元素集中在元素周期表的左下角,答案选a;
(4)a.同一主族元素,从上到下,X值逐渐减小,但是同一主族元素最高正价化合价相同,故a错误;
b.同一主族元素,从上到下,X值逐渐减小,元素吸引电子的能力也逐渐减小,所以X值可反映原子在分子中吸引电子的能力,故b正确;
c.同周期元素,从左到右,X值逐渐增大,非金属性也是逐渐增大,金属性逐渐减小,所以X值的大小可用来衡量元素金属性和非金属性的强弱,故c正确;
答案选bc。


科目:高中化学 来源: 题型:
【题目】在T℃下,向装有5mL0.005mol.L-1FeCl3溶液的试管中加入5mL0.01mol·L-1KSCN溶液,发生如下反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,溶液呈血红色。下列叙述正确的是( )
Fe(SCN)3+3KCl,溶液呈血红色。下列叙述正确的是( )
A.升高温度,逆反应速率减小
B.加入Fe2(SO4)3固体,溶液血红色加深
C.加入KCl固体,溶液血红色加深
D.增大压强,溶液血红色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于不同主族的四种短周期元素甲、乙、丙、丁,其原子序数依次增大,原子半径r(丁)>r(乙)>r(丙)>r(甲)。四种元素中,只有一种为金属元素,乙和丙原子的最外层电子数之和为丁原子的最外层电子数的3倍。据此推断,下述正确的是
A.简单氢化物的沸点:乙>丙
B.由甲、乙两元素组成的化合物溶于水呈碱性
C.丙和丁两元素的最高价氧化物的水化物之间能发生反应
D.由甲和丙两元素组成的分子,不可能含非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 mol·L-1AlCl3溶液中含有的Al3+数目小于NA
B.标准状况下,11 g 3H216O中含有的质子数目为6NA
C.1 mol Li2O和Na2O2的混合物中含有的离子总数大于3NA
D.常温常压下,4.6 g NO2所含的氮原子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是短周期元素,
是短周期元素,![]() 元素原子的最外层电子未达到8电子稳定结构,工业上通过分离液态空气获得其单质;
元素原子的最外层电子未达到8电子稳定结构,工业上通过分离液态空气获得其单质;![]() 元素原子最外电子层上
元素原子最外电子层上![]() 、
、![]() 电子数相等;
电子数相等;![]() 元素的
元素的![]() 价阳离子的核外电子排布与氖原子相同;
价阳离子的核外电子排布与氖原子相同;![]() 元素原子的
元素原子的![]() 层有1个未成对的
层有1个未成对的![]() 电子。下列有关这些元素性质的说法一定正确的是( )
电子。下列有关这些元素性质的说法一定正确的是( )
A.![]() 元素的简单氢化物的水溶液显碱性
元素的简单氢化物的水溶液显碱性
B.![]() 元素的离子半径大于
元素的离子半径大于![]() 元素的离子半径
元素的离子半径
C.![]() 元素的单质在一定条件下能与
元素的单质在一定条件下能与![]() 元素的单质反应
元素的单质反应
D.![]() 元素的最高价氧化物在常温下不是气态
元素的最高价氧化物在常温下不是气态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰在锰系产品中具有重要地位,由软锰矿(MnO2) 和硫铁矿(FeS2)制备流程如下:

(1)从“除质2”后的溶液中得到MnSO4的操作为______、降温结晶、过滤和干燥。
(2)下图是在一定条件下,不同浓度的硫酸对各元素浸出率的影响,由此得出的相关结论是:

①__________;②__________。提高软锰矿浸出率的措施还有______和_______。
(3)除铁剂为H2SO5和氨水。
①H2SO5 中S的化合价为+6,其中过氧键的数目为______,加入其目的是_________。
②写出Fe3+生成沉淀黄铵铁矾NH4Fe3(SO4)2(OH)6的离子方程式____________。
(4)工业除质剂为MnF2,发生反应为(已知,该温度下MnF2、CaF2 和MgF2 的Ksp分别为5.0×10-3、2.0×10-10、8.0×10-11)
反应I:MnF2(s) +Ca2+=CaF2(s) +Mn2+
反应II:MnF2(s) +Mg2+=MgF2(s) + Mn2+
若滤液中c(Mg2+) =0.02 mol/L,加入MnF2(s),使Ca2+恰好沉淀完全即溶液中c(Ca2+) =1.0×10-5mol/L,此时是否有MgF2 沉淀生成?_________(列式计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,能达到实验目的的是
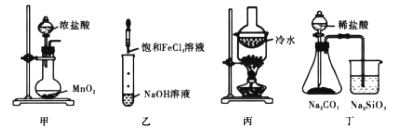
A.甲用于制取氯气
B.乙可制备氢氧化铁胶体
C.丙可分离I2和 KCl固体
D.丁可比较Cl、C、Si 的非金属性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数,下列说法正确的是
A.用氢氧燃料电池电解饱和食盐水得到 0.4mol NaOH,在燃料电池的负极上消耗氧气分子数为 0.1 NA
B.2 mol H3O+中含有的电子数为 20 NA
C.密闭容器中 1 mol N2(g)与 3 mol H2 (g)反应制备氨气,形成 6 NA 个 N-H 键
D.32 g N2H4中含有的共用电子对数为6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() CH=CH-CHO),杏仁含苯甲醛(
CH=CH-CHO),杏仁含苯甲醛(![]() CHO)。下列说法错误的是
CHO)。下列说法错误的是
A. 肉桂醛,苯甲醛都能发生加成反应、取代反应和聚合反应
B. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C. 肉桂醛和苯甲醛互为同系物
D. 苯甲醛分子中所有原子可能位于同一平面内
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com