
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是

A.酸性强弱:HX>HY>HZ
B.P点对应的溶液中:c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-)
C.各溶液在滴定过程中任何时刻,溶液中水的电离一直受抑制
D.HZ的电离方程式为:HZ![]() H++Z-
H++Z-
【答案】B
【解析】
A.根据V(NaOH)=0可知,0.100 mol/L的HX、HY、HZ溶液中pH大小:HX>HY>HZ,结合溶液酸性越强,pH越小推断三种的酸性强弱;
B.P点对应的溶液中,溶质为等浓度的HY和NaY,溶液呈酸性,则HY的电离程度大于Y-的水解程度;
C.对于强酸恰好完全中和时,反应产生的盐对水的电离平衡无影响。
D.0.100 mol/LHZ的pH=1,则HZ为强酸。
A.由图象可知,V(NaOH)=0时,溶液的pH大小:HX>HY>HZ,即溶液中c(H+):HX<HY<HZ,则0.100mol/L的HX、HY、HZ的电离程度:HX<HY<HZ,所以酸性强弱:HX<HY<HZ,A错误;
B.P点对应的溶液为等浓度的HY和NaY,溶液呈酸性,则HY的电离程度大于Y-的水解程度,即c(Y-)>c(Na+)>c(HY),溶液显酸性,则离子浓度c(H+)>c(OH-),即c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-),B正确;
C.在未滴加NaOH溶液时,0.100mol/LHZ的pH=1,说明c(H+)=0.100mol/L=c(HZ),则HZ是一元强酸,在加入20.00mLNaOH溶液时,NaOH与强酸HZ恰好中和产生强酸强碱盐NaZ,此时溶液中水的电离平衡不受到任何抑制作用,C错误;
D.0.100 mol/LHZ的pH=1,则HZ为强酸,电离方程式为HZ=H++Z-,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】M是一种化工原料,可以制备一系列物质(见下图)。
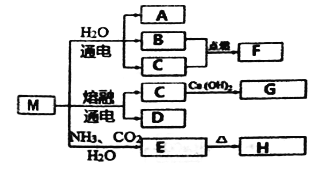
下列说法正确的是
A. 元素C、D形成的简单离子半径,前者大于后者
B. F的热稳定性比H2S弱
C. 化合物A、F中化学键的类型相同
D. 元素C、D的最高价氧化物的水化物均可以和H发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中为实验室制取氯气及性质验证的装置图:
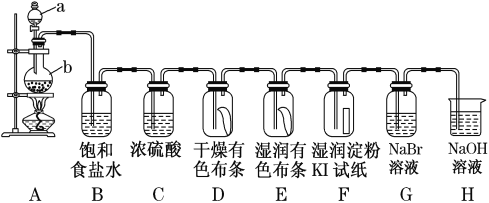
参考装置图回答下列问题:
(1)请指出仪器a的名称____________________,写出装置A中反应的化学方程式____________
(2)在装置D中可观察到的现象是________,装置E中可观察到的现象是__________。
(3)装置B的作用为_____,装置C的作用为____________,装置H的作用为_________,写出装置H中的离子方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)写出⑧的氢化物和②的氢化物反应的化学方程式________。
(2)在元素①~⑧中,非金属性最强的元素是________(填元素名称)。
(3)写出元素②的最高价氧化物对应水化物的电离方程式________。
(4)写出⑤⑧最高价氧化物的水化物之间的离子反应________________。
(5)由②和⑧组成的化合物中各原子均满足稳定结构,写出该化合物的结构式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中加入4 mol A和2 mol B进行反应:3A(g)+2B(g) ![]() 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后的压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后的压强之比为5∶4(相同的温度下测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是K=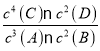
B.此时,B的平衡转化率是35%
C.增大该体系的压强,平衡正向移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种太阳能驱动的H2S分解装置,工作原理如图所示。下列叙述正确的是( )
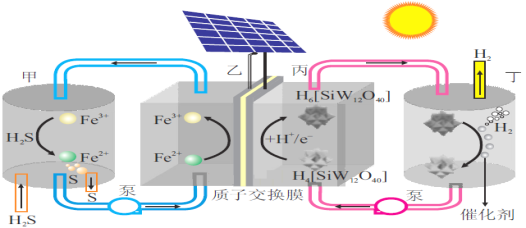
A.甲区发生反应的离子方程式为:2Fe3++S2-=2Fe2++S↓
B.理论上每生成1molS时,H+由质子交换膜右侧向左侧移动的物质的量为2mol
C.丙区发生的电极反应为:H4[SiW12O40]+2e-+2H+=H6[SiW12O40]
D.丁区H6[SiW12O40]在催化剂表面发生电化学反应生成H4[SiW12O40]和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用50mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
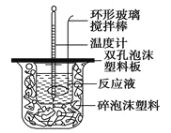
(1)烧杯间填满碎泡沫塑料的作用是______________;
(2)环形玻璃搅拌棒_______(填“能”或“不能”)用环形铁质搅拌棒代替,其原因是________;
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是___________。实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量______ (填“相等”“不相等”),若实验操作均正确,则所求中和热_______ (填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:________。
Ⅱ.FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。已知25℃,101 kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480 kJ·mol-1
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应2XY(g)![]() X2(g)+Y2(g) 达到平衡的标志是
X2(g)+Y2(g) 达到平衡的标志是
A. 单位时间内,生成nmolX2的同时,生成nmolXY
B. 单位时间内, 生成nmolX2的同时,生成nmolY2
C. 单位时间内,生成2nmolXY的同时,消耗nmolY2
D. 单位时间内,生成nmolX2的同时,消耗nmolY2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,它是用两根金属做电极插入KOH溶液中,然后向两极上分别通甲烷和氧气,其电池反应为:X极:CH4+10OH-![]() 8e-=CO32-+7H2O ,Y极:4H2O+2O2+8e-=8OH-,下列关于此燃料电池的有关说法中错误的是( )
8e-=CO32-+7H2O ,Y极:4H2O+2O2+8e-=8OH-,下列关于此燃料电池的有关说法中错误的是( )
A. 通过甲烷的电极(X)为电池的负极,通过氧气的电极(Y)为电池正极
B. 放电一段时间后,电解质溶液中KOH的物质的量改变
C. 在标准状况下,通过5.6L氧气,完全反应后有1.0mol的电子发生转移
D. 放电时,通过甲烷的一极附近的pH升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com