
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( )
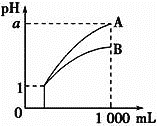
①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A. ①④B. ②③C. ②④D. ①③
【答案】D
【解析】
强酸溶液稀释10n倍,pH升高n个单位,弱酸溶液存在电离平衡,稀释10n倍,pH升高不到n个单位。
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,①稀释1000倍,弱酸溶液pH升高不到3个单位,a<4,则A是弱酸,B的酸性更弱,则A、B都是弱酸说法正确;②稀释后,由图可知,A酸溶液比B酸溶液pH更大,酸性更弱,稀释后,A酸溶液的酸性比B酸溶液强说法错误;③稀释1000倍,A酸溶液pH升高3个单位,说明A为强酸,B酸溶液pH升高不到3个单位,说明B是弱酸,若a=4,则A是强酸,B是弱酸,说法正确;④稀释前pH=1的两种酸溶液A、B,只能说明c(H+)相等,A、B两种酸溶液的物质的量浓度与酸的元数,酸性强弱有关,一定相等说法不正确。答案选C。


科目:高中化学 来源: 题型:
【题目】如图是某反应的微观示意图,下列叙述错误的是

A.生成的M和E的分子个数比为l:1
B.反应中,氮元素和碳元素的化合价发生了改变
C.反应前后元素的种类没有改变,原子的个数发生了改变
D.R和M的化学性质不同,其根本原因是分子不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 化学键的断裂和形成是化学反应中能量变化的主要原因
B. 已知常温下Ksp[Mg(OH)2]=1.8×10-11,则Mg(OH)2在pH=12的NaOH溶液中的溶解度约为1.044×10-6g
C. 水能,风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源
D. 用酚醛树脂制成的塑料可反复加热熔融加工
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25℃时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向浓度均为l×10-3mol/L的KCl和K2CrO4混合液中滴加l×10-3mol/LAgNO3溶液,CrO42-先形成沉淀
C. 碳酸钠溶液中滴加少量氯水的离子方程式为CO32-+Cl2+H2O=HCO3-+Cl-+HClO
D. 向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等有重要意义。
(1)用CO可以合成甲醇,已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJmol-1;
O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJmol-1;
CO(g)+![]() O2(g)=CO2(g) △H=-283.0 kJmol-1;
O2(g)=CO2(g) △H=-283.0 kJmol-1;
H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJmol-1;
O2(g)=H2O(l) △H=-285.8kJmol-1;
则CO(g)+2H2(g)![]() CH3OH(g) △H=___kJmol-1。
CH3OH(g) △H=___kJmol-1。
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是___(填写序号)。
a.使用催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为VL的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醛,平衡转化率与温度、压强的关系如图1所示。
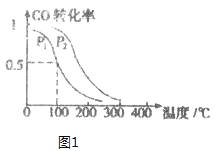
①P1___P2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=______;
③100℃,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、H2、CH3OH各0.5a mol,则平衡___(填“向左”“不”或“想右”)移动。
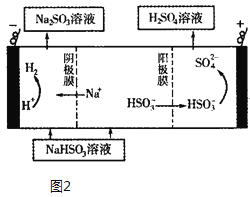
(4)利用原电池原理,用SO2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触,请写出该电池的负极的电极反应式___;
(5)Na2SO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为______。用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液,电解原理示意图如图2所示。请写出该电解池发生反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前“低碳减排”备受关注,![]() 的产生及有效开发利用成为科学家研究的重要课题。
的产生及有效开发利用成为科学家研究的重要课题。

(1)汽车尾气净化的主要原理为![]() 。在密闭容器中发生该反应时,
。在密闭容器中发生该反应时,![]() 随温度
随温度![]() 、催化剂表面积
、催化剂表面积![]() 和时间
和时间![]() 的变化曲线如图1示。据此判断:
的变化曲线如图1示。据此判断:
①该反应的![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
②在![]() 温度下,
温度下,![]() 内的平均反应速率
内的平均反应速率![]() ______
______![]() 。
。
③当固体催化剂的质量一定时,增大其表面积可增大化学反应速率。若催化剂的表面积![]() ,在答题卡相应图中画出
,在答题卡相应图中画出![]() 在
在![]() 、
、![]() 条件下达到平衡过程中的变化曲线_____。
条件下达到平衡过程中的变化曲线_____。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图如图2正确且能说明反应在进行到![]() 时刻达到平衡状态的是______
时刻达到平衡状态的是______![]() 填代号
填代号![]() 。
。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用![]() 催化还原
催化还原![]() 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。
例如:![]()
![]()
写出![]() 催化还原
催化还原![]() 生成
生成![]() 、
、![]() 和
和![]() 的热化学方程式:______。
的热化学方程式:______。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图3通过人工光合作用,以![]() 和
和![]() 为原料制备HCOOH和
为原料制备HCOOH和![]() 的原理示意图。催化剂b表面发生的电极反应为______
的原理示意图。催化剂b表面发生的电极反应为______
③常温下![]() 的HCOONa溶液pH为10,则HCOOH的电离常数
的HCOONa溶液pH为10,则HCOOH的电离常数![]() ______
______![]() 填写最终计算结果
填写最终计算结果![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将体积均为1 mL、浓度均为0.10 mol/L的XOH和X2CO3溶液分别加水稀释至体积为V mL,pH随lg V的变化情况如图所示,下列叙述中正确的是

A. XOH是弱碱
B. pH=10的两种溶液中的c(X+):XOH>X2CO3
C. 已知H2CO3的电离平衡常数Ka1远大于Ka2,则Ka2约为1.0×1010.2
D. 当lg V=2时,若X2CO3溶液的温度升高,溶液碱性增强,则 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com