
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A. 饱和氯水中:Cl-、NO3-、Na+、SO32-
B. ![]() =10-13 mol·L-1 溶液中:NH4+、Mg2+、NO3-、SO42-
=10-13 mol·L-1 溶液中:NH4+、Mg2+、NO3-、SO42-
C. 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3-
D. Na2S溶液中:SO42-、K+、Cl-、Cu2+
科目:高中化学 来源: 题型:
【题目】多个氨基酸分子缩合成含两条肽链的蛋白质时,相对分子量减少了900,由此可推知:此蛋白质分子所含的氨基酸数和肽键数分别是( )
A. 52、52 B. 50、50 C. 52、50 D. 50、49
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C元素的最高价氧化物的水化物是一种中强碱,甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述正确的是( )
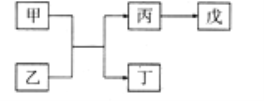
A. C、D两元素形成化合物属共价化合物
B. C、D的简单离子均能促进水的电离
C. A、D分别与B元素形成的化合物都是大气污染物
D. E的氧化物水化物的酸性大于D的氧化物水化物的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
(1)火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
①用铅精矿火法炼铅的反应的化学方程式为____________________________。
②火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为_____________________________________________________。
(2)湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:

已知:PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq) + 2Cl-(aq) ![]() PbCl42-(aq)
PbCl42-(aq)
不同温度下PbCl2的溶解度如下表所示:
温度(℃) | 20 | 40 | 60 | 80 | 100 |
溶解度(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
①浸取液中FeCl3的作用是________________________________。
②操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中充有2molSO2和一定量O2发生下列反应2SO2+O2![]() 2SO3,经4min后测得SO2为0.4mol,则O2的反应速率是
2SO3,经4min后测得SO2为0.4mol,则O2的反应速率是
A. 0.1mol/(L·min)B. 0.2mol/(L·min)
C. 0.3mol/(L·min)D. 0.05mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧硫酸铝铵晶体,发生的主要反应为4[NH4Al(SO4)2·12H2O] ![]() 2A12O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过下图所示的装置(假设试剂均过量)。下列说法正确的是
2A12O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过下图所示的装置(假设试剂均过量)。下列说法正确的是

A. 反应中硫元素既体现氧化性又体现还原性
B. 装置Ⅰ中可以观察到出现白色沉淀,其主要成分是BaSO4和BaSO3
C. 装置Ⅱ中可以观察到高锰酸钾紫色褪去
D. 将装置Ⅰ、Ⅱ顺序交换,仍能观察到相同的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成生物体化学元素的论述,正确的是 ( )
A. 组成生物体和组成无机自然界的化学元素中,碳元素的含量最多
B. 人、动物和植物所含的化学元素的种类差异很大
C. 组成生物体的化学元素在无机自然界都可以找到
D. 构成细胞的最基本元素是氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸氯(ClNO)可由NO与Cl2在通常条件下反应得列,化学方塑式为2NO(g) + Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率_____( 填增大、减少、不变).
(2)己知几种化学键的键能数据如下表( 亚硝酸氯的结构为Cl-N=O)
化学键 | N≡O | Cl一Cl | Cl一N | N=O |
键能/kJ.mol-1 | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) △H=-111kJ/mol,则a=_______。
2ClNO(g) △H=-111kJ/mol,则a=_______。
(3)在1L的恒容密闭容器中充入2molNO(g)和1mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
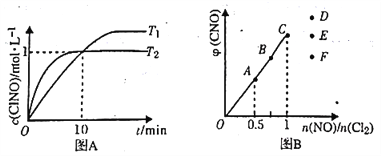
①该反应的△H_____0(填“>”“<”或“=”)。
②反应开始到10min 时NO 的平均反应速率v( NO) =________mol/(L.min).
③T2时该反应的平衡常数K=________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图象如图B,则A、B、C 三状态中,NO 的转化率最大的是___点,当n(NO)/n(Cl2)=1.5时,达到平街状态ClNO 的体积分数可能是D、E、F三点中的______点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量转换的认识中错误的是
A.电解水时,电能转化为化学能
B.电动车行进时,电能主要转化为化学能
C.煤燃烧时,化学能主要转化为热能
D.水力发电时,机械能转化为电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com