
已知下列元素的原子半径:
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
科目:高中化学 来源: 题型:填空题
材料是科学技术进步的关键,是科学技术和社会发展的物质基础。材料的发展不仅影响了人类的昨天和今天,而且还将影响到人类的明天。请回答以下与材料有关的问题。
(1)无机非金属材料。单晶硅是一种比较活泼的非金属元素,是晶体材料的重要组成部分,处于新材料发展的前沿。其主要用途是用做半导体材料和利用太阳能光伏发电、供热等。单晶硅的制备方法如下:
①写出步骤①的化学方程式:______________________。
②已知以下几种物质的沸点:
| 物质 | SiHCl3 | SiCl4 | HCl |
| 沸点 | 33.0 ℃ | 57.6 ℃ | -84.7 ℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X2、Y2单质在一定条件下有如下反应:X2+Y2+H2O→HXO3+HY(未配平)。
按要求回答下列问题:
(1)X2、Y2可能的组合是__________________。
a.F2、Br2 b.I2、Cl2 c.C12、O2 d.Br2、N2
(2)试比较X2、Y2、HXO3的氧化性强弱:___________________[用(1)中所选的X2、Y2回答,下同]。判断HXO3+HX能否反应:___________(填“能”或“不能”)。若能反应,请写出其化学反应方程式,若不能反应,请说明理由:____________________。
(3)若用KX制取HX,不能选用浓硫酸的原因是________________________。(用化学方程式表示)
(4)工业上测定某产品中YO-的含量,先将一定量产品的溶液加入过量的KX溶液和稀硫酸中,使之反应生成X2,试写出上述反应的离子方程式:______________________。
(5)Fe2+、Fe3+、X2、X-、Y-五种微粒中的两种微粒A(阳离子)和B在溶液中能相互反应生成X2,向含微粒A的溶液中滴入足量l mol/LNa2S溶液,生成的沉淀C与足量的热NaOH溶液反应,过滤,残渣D再与稀硫酸完全反应生成E溶液。则生成的沉淀C的成份是(填化学式)____________________。E溶液中阳离子除H+外,另外的阳离子的检验方法是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为部分短周期元素化合价与原子序数的关系图。请回答下列问题。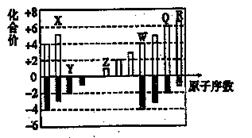
(1)元素Q位于周期表中第 周期______族。
(2)将X、Z、Q、R四种元素的氢化物各1mol和水混合后,分剜得到l L溶液,所得水溶液碱性最强的氢化物的电子式是 。
(3)Z的最高价氧化物对应的水化物与W的单质反应的化学方程式为 。
(4)水中锰含量超标,容易使洁具和衣物染色、使水产生异味。RY2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,同时测得消耗13.50 g RY2时,共转移了1 mol电子。则反应的离子方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
同位素2H、15N、18O、34S等常被用做陆地生态分析研究。下列说法中正确的是
| A.16O和18O是同一种核素 | B. 1H218O的摩尔质量为20 |
| C.34S和15N核内的中子数相差9 | D.2H+核外电子数为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于F、Cl、Br、I的比较,说法正确的是
| A.原子最外层的电子数随核电荷数的增加而增多 |
| B.简单阴离子的还原性随核电荷数的增加而增强 |
| C.氢化物的稳定性随核电荷数的增加而增强 |
| D.非金属性随核电荷数的增加而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X?Y?Z的原子序数依次增大,Y为IA族元素,X与Z同主族,3种元素原子的最外层电子数之和为13?下列判断正确的是
| A.Y元素位于第2周期 | B.Y?Z均能与X形成不只一种化合物 |
| C.X是ⅤA族元素 | D.氢化物的稳定性:HnZ>HnX |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z- ,
Y+和Z-离子具有相同的电子层结构。下列说法不正确的是( )
| A.原子最外层电子数:Z>X>Y | B.氢化物的稳定性:Z>X |
| C.离子半径:X2->Y+>Z- | D.原子序数:X>Y>Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com