

| ||
| ||
| ||
| ||
 ,
, ;
;| 3 |
| 4 |
| 3 |
| 4 |


科目:高中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| n |
| 2 |
| 3n |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/°C | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在澄清石灰水中加入少量小苏打:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| B、苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| C、将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
| D、将标准状况下112mL氯气通入10mL浓度为1mol?L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2═3Fe3++6Cl-+2Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
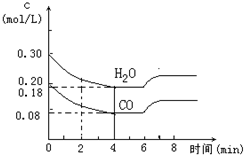
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,用0.1mol/L CH3COOH溶液滴定20mL O.1mol/L NaOH溶液的滴定曲线如图所示,则在混合后的溶液中下列粒子浓度的关系式干不正确的是(忽略溶液混合时体积变化)( )
常温下,用0.1mol/L CH3COOH溶液滴定20mL O.1mol/L NaOH溶液的滴定曲线如图所示,则在混合后的溶液中下列粒子浓度的关系式干不正确的是(忽略溶液混合时体积变化)( )| A、pH=8时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、a点时:c(OH-)=c(H+)+c(CH3COO-)+c(CH3COOH) |
| C、PH=7时:c(CH3COO-)+c(H+)=c(Na+)+c(OH-) |
| D、b点时:c(CH3COO-)+c(CH3COOH)=0.05mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能说明NH3结合H+能力比H2O强:NH3+H2O?NH4++OH- |
| B、能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O |
| C、能说明盐酸的酸性比碳酸强:2HCl+CaCO3=CaCl2+H2O+CO2↑ |
| D、能说明CH3COOH是弱酸:CH3COO-+H2O?CH3COOH+OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com