
下列化学用语表示正确的是( )
A.Cl-的结构示意图:
B.甲烷分子的球棍模型:
C.氢氧化钠的电子式:
D.次氯酸的结构式:H—O—Cl
科目:高中化学 来源: 题型:
下列离子方程式中书写正确的是
A.过氧化钠与水反应:2Na2O2+2H2O=4Na++4OH-+O2↑
B.用氢氧化钡溶液中和硫酸溶液:Ba2++OH-+H++SO42-=H2O+BaSO4↓
C.金属钠与水反应:Na +2H2O=Na++2OH-+H2↑
D.在澄清石灰水中通入过量的CO2:Ca2++2OH-+2CO2=Ca(HCO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
二茂铁[(C5H5)2Fe] 分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料。它的结构如右图所示,下列说法正确的是( )
 A.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为离子键
A.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为离子键
B.1mol环戊二烯(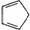 )中含有σ键的数目为5NA
)中含有σ键的数目为5NA
C.分子中存在π键
D.Fe2+的电子排布式为1s22s22p63s23p63d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关气体体积的叙述中,正确的是 ( )。
A.在一定的温度和压强下,各种气态物质体积的大小由气体分子的大小决定
B.在一定的温度和压强下,各种气态物质体积的大小由物质的量的多少决定
C.不同的气体,若体积不同,则它们所含的分子数一定不同
D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
①48 g RO42-中,核外电子总数比质子总数多6.02×1023个,则R原子的摩尔质量为________。
②有一真空瓶的质量为M1 g,该瓶充入空气后总质量为M2 g;在相同状况下,若改充某气体A后,总质量为M3 g,则A的相对分子质量为________。
(2)(2014届江西师大附中期末)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol·L-1的NaOH溶液(密度为1.12 g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。
①原NaOH溶液的质量分数为________
②所得溶液中Cl-的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.将铜屑加入Fe3+溶液中:Fe3++Cu===Fe2++Cu2+
B.NH4HCO3溶液与过量KOH浓溶液共热:
NH +OH-
+OH- NH3↑+H2O
NH3↑+H2O
C.稀硝酸和过量的铁屑反应:
Fe+4H++NO ===Fe3++NO↑+2H2O
===Fe3++NO↑+2H2O
D.KI溶液与H2SO4酸化的H2O2溶液混合:
2I-+H2O2+2H+===I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
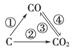
(1)右图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为______________________________________;
图中变化过程哪些是吸热反应________(填序号)。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)CH3OH(g)
方法二 CO2(g)+3H2(g)CH3OH(g)+H2O(g)
在25℃、101 kPa下,1克甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧的热化学方程式:_____________________________________________;
某火力发电厂CO2的年度排放量是2 200万吨,若将此CO2完全转化为甲醇,则理论上由此获得的甲醇完全燃烧放热约是________kJ(保留三位有效数字)。
(3)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2高温,TiCl4+2CO 已知:C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH=________。
(4)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)===3Ag2O(s) ΔH=-235.8 kJ·mol-1,
已知:2Ag2O(s)===4Ag(s)+O2(g)
ΔH=+62.2 kJ·mol-1,
则O3转化为O2的热化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A:4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
 已知:Ⅰ.反应A中,4mol HCl被氧化,放出115.6kJ的热量.
已知:Ⅰ.反应A中,4mol HCl被氧化,放出115.6kJ的热量.
Ⅱ. 则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 ( )
A.16kJ B.24kJ C.32kJ D.48kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液的说法正确的是
A.蒸馏水中逐渐加入NaOH(s)的过程中KW不变
B.CaCO3难溶于稀硫酸,更难溶于醋酸
C.在Na2CO3稀溶液中,c(H+) + c(Na+) = c(OH-) + 2c(CO32—) + c(HCO3-)
D.NaCl溶液和BaCl2溶液中水的KW不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com