
【题目】碳酸钠与工农业生产、日常生活紧密相关。工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案。请回答下列有关问题:方案一:沉淀分析法(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀_______(填操作)、洗涤、烘干、称量,洗涤沉淀的操作是____________________。方案二:气体分析法(2)把一定量的样品与足量盐酸反应后,用下图所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用______________________,但选用该溶液后实验结果仍然不够准确,其原因是___________________。
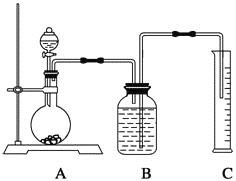
方案三:质量差分析法(3)把一定质量的样品和足量的稀硫酸反应,采用下图所示装置,通过称量反应前后盛有碱石灰的干燥管的质量,利用其质量差求算样品的纯度。
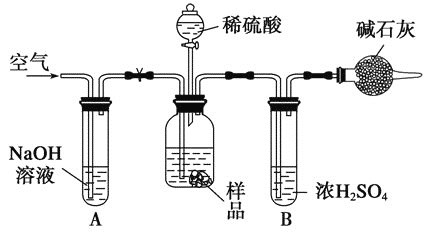
该实验的操作步骤有:①在干燥管内填满碱石灰,质量为m g;②取n g样品装入广口瓶中;③检验装置的气密性;④缓慢鼓入空气数分钟,再称量干燥管质量为w g;⑤关闭止水夹;⑥打开止水夹;⑦缓慢加入稀硫酸至不再产生气体为止;⑧缓慢鼓入空气数分钟。Ⅰ.正确的操作顺序是(填序号):③→__________→⑥→________→⑤→________→⑦→_______→④。Ⅱ.若去掉装置A,测定结果________;若去掉装置B,测定结果________(填“偏大”、“偏小”或“无影响”)。
【答案】过滤沿玻璃棒缓慢地向过滤器中加蒸馏水至浸没沉淀物,使水自然流下,重复2~3次饱和NaHCO3溶液CO2中混有的HCl与NaHCO3溶液反应生成CO2② ⑧ ① ⑥偏大偏大
【解析】(1)发生Na2CO3+CaCl2=CaCO3↓+2NaCl,测量碳酸钠的质量分数,需要测量沉淀的质量,因此操作是过滤,洗涤沉淀的方法是沿玻璃棒缓慢地向过滤器中加蒸馏水至浸没沉淀物,使水自然流下,重复2~3次;(2)本实验需要通过排水法测量CO2的体积,但CO2能溶于水,因此B中盛放饱和碳酸氢钠溶液,减少CO2的溶解,减少误差;产生的CO2中混有HCl,HCl和碳酸氢钠反应产生CO2,测量的CO2的体积增大,B和C的导管中会有小部分液体,造成CO2的体积减小;(3)I.此实验有气体参加反应,需要检验装置的气密性,即③,装入药品,即②,打开止水夹,装置中含有空气,空气中有CO2,对CO2的测定产生干扰,因此必须除去,缓慢通入空气,关闭止水夹,干燥管中装满碱石灰,并称量其质量,打开分液漏斗的活塞,缓慢滴入稀硫酸, 至到不再产生气体为止,打开止水夹,缓慢通入一段时间空气,让产生的CO2全部被吸收,再称量干燥管的质量,顺序是③→②→⑥→⑧→⑤→①→⑦→⑥→④;II.装置A的作用是吸收空气中CO2,如果去掉,则造成CO2的质量增大,即碳酸钠的质量增大,测定结果偏大;装置B作用是吸收CO2的水,如果去掉,水被碱石灰吸收,所测碳酸钠的质量增大,即结果偏高。


科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)=2H2O(l) △H=-Q1kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-Q2kJ/mol
CH4(g)+2O2(g)=2H2O(l)+CO2(g) △H=-Q3kJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2 L(标准状况下)经完全燃烧后恢复到常温,则放出的热量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W![]() X+H2O+CO2↑
X+H2O+CO2↑
②Z+CO2―→X+O2
③Z+H2O―→Y+O2↑
④X+Ca(OH)2―→Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是W:________、X:________、Y:________、Z________。
(2)以上4个化学反应,属于氧化还原反应的是______________(填反应序号),反应中氧化剂是__________(写化学式),氧化产物是____________(写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
①离子方程式:_____________________________________________。
②化学方程式:________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。W的单质与H2在暗处能化合并发生爆炸,X是同周期中金属性最强的元素,Y原子的最外层电子数等于电子层数,W和Z原子的最外层电子数相同。下列说法错误的是( )
A. 单质的沸点:Z>W
B. 简单离子半径:X>W
C. 元素X与氧可形成既含离子键也含非极性共价键的化合物
D. X、Y、Z的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 人体中含量最多的是氧元素
B. 我国加工碘盐中加入了碘酸钾
C. 人体内需要大量铁,所以用铁锅炒菜好
D. 我国将酱油作为铁强化食物的载体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图像的说法中正确的是
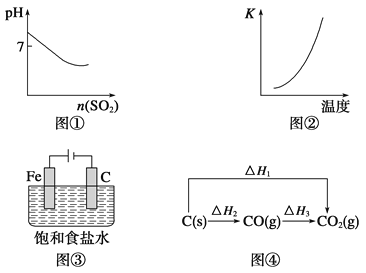
A.图①表示将SO2气体通入溴水中
B.图②表示反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0的平衡常数K随温度的变化
2NH3(g) ΔH<0的平衡常数K随温度的变化
C.图③中阴、阳两极收集到的气体体积之比一定为1∶1
D.图④中的ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在xR2+ +yH++O2=mR3+ +nH2O的离子方程式中,对m和R3+判断正确的是:
A. m=4,R3+是氧化产物
B. m=2y,R3+是氧化产物
C. m=2,R3+是还原产物
D. m=y,R3+是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是 ( )
A. 物质所含元素化合价升高的反应叫还原反应
B. 在氧化还原反应中,失去电子的元素化合价降低
C. 物质中某元素失去电子,则此物质是氧化剂
D. 还原剂中必定有一种元素被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com