
【题目】在体积为2 L的密闭容器中,充入2mol CO2 和2mol H2,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = _____________;
(2)该反应为____________反应(选填“吸热”或“放热”);
(3)能判断该反应是否达到化学平衡状态的依据是______________;
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ正(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
【答案】![]() 吸热 b 830
吸热 b 830
【解析】
(1)根据化学平衡常数的概念来书写;
(2)根据温度对化学平衡、化学平衡常数的影响来回答;
(3)化学平衡状态的标志:正逆反应速率相等;
(4)根据浓度熵和平衡常数的关系来回答;
(1)因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K =![]() ;
;
(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热,故答案为:吸热;
(3)a.反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,故a 错误;
b.化学平衡时,各组分的浓度不随时间的改变而改变,故b正确;
c.化学平衡状态的标志是![]() ,所以
,所以 ![]() 表明反应达到平衡状态,故c错误;
表明反应达到平衡状态,故c错误;
d.![]() 时,没有标明正逆反应速率,不能表明正逆反应速率相等,不一定达到了平衡状态,故d 错误;
时,没有标明正逆反应速率,不能表明正逆反应速率相等,不一定达到了平衡状态,故d 错误;
故选b;
(4)平衡浓度符合下式![]() 时,平衡常数相等均等于1,平衡常数只值受温度的影响,当K=1时,根据表中数据,所以温度是830℃,故答案为830;
时,平衡常数相等均等于1,平衡常数只值受温度的影响,当K=1时,根据表中数据,所以温度是830℃,故答案为830;


科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)为白色晶体,是强氧化剂,常用作火箭发射的推进剂。已知:①NH4ClO4在400℃时开始分解,产物为N2、Cl2、O2、H2O;②Mg3N2易水解。请用下图所示装置设计实验证明分解产物中含有Cl2、H2O以及装置A中生成了Mg3N2(装置不重复使用)。
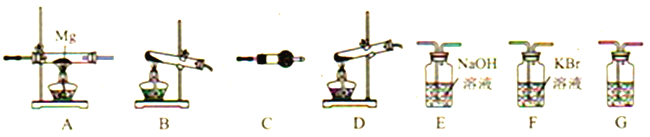
(1)写出高氯酸铵分解的化学方程式__________。
(2)高氯酸铵分解选择的装置是__________(填字母)。
(3)按气流从左到右,装置的连接顺序是:分解装置→_____→_____→_____→_____→_____。______________
(4)C中所放的试剂是__________,G的作用是__________ 。
(5)能证明有Cl2产生的现象是__________。
(6)要证明装置A中生成了Mg3N2需要进行的实验操作以及对应的实验现象是__________。
(7)某实验宣存放的高氯酸铵样品中含有少量杂质,已知可用蒸馏法测定NH4ClO4的含量,其测定流程如下(杂质不参加反应),则样品中NH4ClO4的含量(w)为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时,加入一定量的NO、O2,发生如下反应:2NO(g)+O2(g) ![]() 2NO2(g) ΔH< 0,反应过程中n(NO)随时间的变化如下表:
2NO2(g) ΔH< 0,反应过程中n(NO)随时间的变化如下表:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 |
n(NO)/mol | 0. 20 | 0. 10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)计算该反应在20秒内用O2表示的反应速率v(O2)= ______________ ;
(2)写出该反应的平衡常数表达式____________。升高温度该反应平衡常数会_______(填“增大”“减小”或“不变”)
(3)下列示意图正确且能说明反应达到平衡状态的是___________

(4)能使该反应的反应速率增大,且NO的平衡转化率也增大的是__________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(5)已知:2NO(g)![]() N2(g)+O2(g) K1=1×1030;2CO2(g)
N2(g)+O2(g) K1=1×1030;2CO2(g)![]() 2CO(g)+O2(g)K2= 4×10-92。随着轿车进入家庭,汽车尾气(含碳氢化合物、一氧化碳、二氧化硫、一氧化氮等物质)污染成为备受关注的环境问题,某市政府要求全市新有汽车尾气处理装置完成改装,改装后的尾气处理装置主要是加了有效催化剂。请你根据以上有关数据回答:
2CO(g)+O2(g)K2= 4×10-92。随着轿车进入家庭,汽车尾气(含碳氢化合物、一氧化碳、二氧化硫、一氧化氮等物质)污染成为备受关注的环境问题,某市政府要求全市新有汽车尾气处理装置完成改装,改装后的尾气处理装置主要是加了有效催化剂。请你根据以上有关数据回答:
①2NO(g)+2CO(g) ![]() N2(g)+ 2CO2(g) K=_____________
N2(g)+ 2CO2(g) K=_____________
②仅使用催化剂_______(填“能”或“否”)消除NO、CO污染气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用滴有酚酞和氯化钠溶液的湿润滤纸分别做甲、乙两个实验,下列判断不正确的是( )
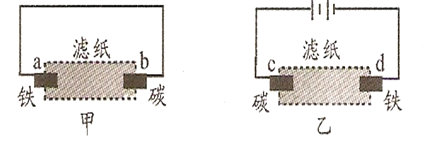
A.b极附近有气泡冒出B.d极附近出现红色
C.a、c极上都发生氧化反应D.甲中铁棒比乙中铁棒更易腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3molA、0.1molC和一定量B三种气体。一定条件下发生反应,各物质浓度随时间变化如图甲所示[t0~t1阶段c(B)未画出]。图乙为t2时刻后改变条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种条件并且所用条件均不相同。已知t3~t4阶段为使用催化剂。下列说法正确的是( )

A. 若t1等于15s,生成物C在t0~t1时间段的平均反应速率为0.004mol/(Ls)
B. t4~t5阶段改变的条件为降低反应温度
C. B的起始的物质的量为0.02mol
D. t5~t6阶段可能是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)=2G(g)忽略固体体积,平衡时G的体积分数![]() 随温度和压强的变化如表所示:
随温度和压强的变化如表所示:
| 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | b |
915 | c | 75.0 | d |
1000 | e | f | 83.0 |
①b>f ②915℃,2.0MPa时E的转化率为60% ③该反应的S>0 ④K(1000℃)>K(810℃)。上述中正确的有
A.4个B.3个C.2个D.1个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g)+yB(?) ![]() zC(g);平衡时测得A的浓度为0.45 mol/L,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得A的浓度增大为0.9 mol/L。下列有关判断正确的是
zC(g);平衡时测得A的浓度为0.45 mol/L,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得A的浓度增大为0.9 mol/L。下列有关判断正确的是
A. 各物质的计量数一定满足:x+y=z
B. 若B为气体,压缩后B的体积分数增大,转化率降低
C. 无论B为固体或气体,压缩后B的质量都不会改变
D. 压缩时,平衡向逆反应方向移动,且正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示中正确的是
A.电子式:Na:![]() :Na
:Na
B.中子数为22的钙原子:4222Ca
C.NaHSO3水解的离子方程式:HSO3-+H2O![]() H2SO3+OH-
H2SO3+OH-
D.H2CO3的电离方程式:H2CO3=H++HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com