
����Ŀ����2L�ܱ������ڣ�800��ʱ������һ������NO��O2���������·�Ӧ��2NO(g)��O2(g) ![]() 2NO2(g) ��H�� 0����Ӧ������n(NO)��ʱ��ı仯���±���
2NO2(g) ��H�� 0����Ӧ������n(NO)��ʱ��ı仯���±���
ʱ��/s | 0 | 10 | 20 | 30 | 40 | 50 |
n(NO)/mol | 0. 20 | 0. 10 | 0.08 | 0.07 | 0.07 | 0.07 |
��1������÷�Ӧ��20������O2��ʾ�ķ�Ӧ����v(O2)= ______________ ��
��2��д���÷�Ӧ��ƽ�ⳣ������ʽ____________�������¶ȸ÷�Ӧƽ�ⳣ����_______����������������С��������������
��3������ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����___________

��4����ʹ�÷�Ӧ�ķ�Ӧ����������NO��ƽ��ת����Ҳ�������__________��
a����ʱ�����NO2���塡�� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч����
��5����֪��2NO(g)![]() N2(g)+O2(g) K1=1��1030��2CO2(g)
N2(g)+O2(g) K1=1��1030��2CO2(g)![]() 2CO(g)��O2(g)K2= 4��10��92�����Žγ������ͥ������β������̼�⻯���һ����̼����������һ�����������ʣ���Ⱦ��Ϊ���ܹ�ע�Ļ������⣬ij������Ҫ��ȫ����������β������װ����ɸ�װ����װ���β������װ����Ҫ�Ǽ�����Ч������������������й����ݻش�
2CO(g)��O2(g)K2= 4��10��92�����Žγ������ͥ������β������̼�⻯���һ����̼����������һ�����������ʣ���Ⱦ��Ϊ���ܹ�ע�Ļ������⣬ij������Ҫ��ȫ����������β������װ����ɸ�װ����װ���β������װ����Ҫ�Ǽ�����Ч������������������й����ݻش�
��2NO(g)+2CO(g) ![]() N2(g)+ 2CO2(g) K=_____________
N2(g)+ 2CO2(g) K=_____________
�ڽ�ʹ�ô���_______(����������������)����NO��CO��Ⱦ���塣
���𰸡�0.0015mol/(L��s) K=![]() ��С d c 2.5 ��10121 (mol/L)-1 ��
��С d c 2.5 ��10121 (mol/L)-1 ��
��������
���ݱ������ݣ���Ӧ��30sʱ�ﵽƽ��״̬��
20s 2NO(g)��O2(g) ![]() 2NO2(g)
2NO2(g)
����0.20
����0.12 0.05 0.12
ʣ��0.08
��1��������֪��20sʱ������n(O2)=0.05mol��v(O2)=![]() = 0.0015mol/(L��s)��
= 0.0015mol/(L��s)��
��2��ƽ�ⳣ��K=![]() ����H�� 0������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����K��С��
����H�� 0������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����K��С��
��3��a.��Ӧ��ϵ�и����ʾ�Ϊ���壬���������������䣬�ݻ�Ϊ���ݣ����ܶ���ʼ���ղ��䣬ʾ��ͼ����a����
b.����ʽ�е��ʱ��뷴Ӧ�����ʵ����أ��뷴Ӧ�ļ������йأ����ж��Ƿ�ﵽƽ��״̬��b����
c.��Ӧ��ʼʱ����Ӧ���Ũ�����Ӧ��������淴Ӧ�Ľ��з�Ӧ���Ũ����С����Ӧ���ʼ�С��ʾ��ͼ����c����
d.�淴Ӧ�Ľ��У� NO��Ӧ����������ת���������ﵽƽ��״̬ʱ��NO�������������ﵽƽ��״̬��d��ȷ��
��Ϊd��
��4��a����ʱ�����NO2���壬��Ӧ���˲ʱ��Ӧ���ʲ��䣬�����ⲻ����a����
b���ʵ������¶ȣ���Ӧ���ʼӿ죬ƽ�������ƶ���NO��ת���ʽ��ͣ������ⲻ����b����
c������O2��Ũ�ȣ�����Ӧ���ʼӿ죬ƽ�������ƶ���NO��ת�������������⣬c��ȷ��
d��ѡ���Ч���������淴Ӧ���ʾ�����ƽ�ⲻ�ƶ���ת���ʲ��䣬�����ⲻ����d����
��Ϊc��
��5����K= 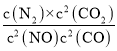 =
=![]() =2.5 ��10121 (mol/L)-1��
=2.5 ��10121 (mol/L)-1��
��KֵԽ��˵�������Ӧ������еij̶�Խ������ô���������NO��CO��Ⱦ���塣


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��298Kʱ��N2��H2��Ӧ�����������仯������ͼ����������������ǣ� ��

A.���¶ȡ����һ���������£�ͨ��1mol N2��3mol H2��Ӧ��ų�������Ϊ92kJ
B.a�����Ǽ������ʱ�������仯�����������ܽ��ͷ�Ӧ�Ļ�ܣ�ʹ��λ����ڻ���Ӱٷ����������
C.��������������Ч��ײ���������������N2��ת����
D.�÷�Ӧ���Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g) ��H= -92kJ/mol
2NH3(g) ��H= -92kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ���صĵ�ط�ӦΪ��![]()
![]()
![]()
![]() ����˵����ȷ����
����˵����ȷ����
A.�ŵ�ʱ�������ķ�Ӧʽ�ǣ�![]()
B.�ŵ�ʱ���������Һ�е�H+���ƶ�
C.���ʱ�������ĵ缫��ӦΪ��![]()
D.���ʱ������20.7gPb����ʱ��ת�Ƶĵ���Ϊ0.1mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£������pH����ͬ������ʹ�����Һ��ˮϡ��ʱ��pH�仯������ͼ��ʾ�������ж���ȷ���ǣ� ��
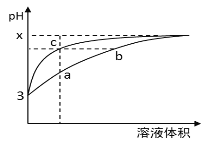
A.c�����Һ����������a���ǿ
B.ˮ�ĵ���̶�a��c = b
C.b��c�����Ӧ����Һ�ֱ���ͬŨ�ȵ�����������Һǡ����ȫ��Ӧ����������������Һ���c���
D.b��c������ڹ�ϵ��c��Cl����=c��CH3COO����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϵ�ⷨ�����������Է�ˮ���õ�����Ni��ԭ����ͼ��ʾ��
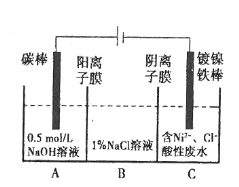
��֪����Ni2+����������Һ�з���ˮ��������ԣ�Ni2+(��Ũ��)��H+��Ni2+(��Ũ��)������˵������ȷ����
A.̼���Ϸ����ĵ缫��Ӧ��4OH����4e-=O2��+2H2O
B.Ϊ�����Ni�IJ��ʣ�����������Ҫ���Ʒ�ˮpH
C.�������У�B��NaCl��Һ�����ʵ���Ũ�Ƚ����ϼ���
D.����ͼ��������Ĥȥ������A��B���Һϲ������ⷴӦ�ܷ���ʽ�����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ�ǹ��÷�չ����Ҫ�������ҹ�Ŀǰʹ�õ���Դ��Ҫ�ǻ�ʯȼ�ϡ�
��1����25 �桢101 kPaʱ��16 g CH4��ȫȼ������Һ̬ˮʱ�ų���������890.31 kJ�����ʾCH4ȼ���ȵ��Ȼ�ѧ����ʽ��_______________________��
��2����֪��C(s) + O2(g)![]() CO2(g) ��H1 ����437.3 kJmol-1
CO2(g) ��H1 ����437.3 kJmol-1
2H2(g) + O2(g) ![]() 2H2O(g) ��H2 ����571.6 kJmol-1
2H2O(g) ��H2 ����571.6 kJmol-1
2CO(g) +O2(g)![]() 2CO2(g) ��H3 ����566.0 kJmol-1
2CO2(g) ��H3 ����566.0 kJmol-1
��ú������Ҫ��Ӧ���Ȼ�ѧ����ʽ�ǣ�C(s)+ H2O(g)![]() CO(g) + H2(g) ��H ��________kJmol-1������÷�Ӧ��S ����133.7 J��mol-1��K-1 ���÷�Ӧ�ڳ����� _______�Է�����(�� ����������������)��
CO(g) + H2(g) ��H ��________kJmol-1������÷�Ӧ��S ����133.7 J��mol-1��K-1 ���÷�Ӧ�ڳ����� _______�Է�����(�� ����������������)��
��3�� ��֪��1molH��H����1molN��H����1molN��N���ֱ���Ҫ��������436kJ��391kJ��946kJ����ӦN2(g)+3H2(g) ![]() 2NH3 (g) ��H ��_________
2NH3 (g) ��H ��_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������X��һ����Ҫ���л�����ԭ�ϣ������ⶨ����Է�������Ϊ92��������Ϊ��ʼԭ����Ƴ�����ת����ϵͼ(���ֲ���ϳ�·�ߡ���Ӧ������ȥ)������A��һ�ȴ��F�ķ���ʽΪC7H7NO2��Y��һ�ֹ��ܸ߷��Ӳ��ϡ�

��֪����
![]()

��
![]()
 (�������ױ�����)
(�������ױ�����)
�������ѧ֪ʶ�뱾��������Ϣ�ش��������⣺
(1)X������_____________����˴Ź�������ͼ��____________�����շ塣
(2)��Ӧ�ݵĻ�ѧ����ʽ��____________��
(3)��˾ƥ�ַ����к��еĹ����ŵ�������_______��1mol��˾ƥ��������NaOH��Һ��Ӧ�������NaOH�����ʵ���Ϊ_______��
(4)Y�Ľṹ��ʽΪ_______��
(5) �ж���ͬ���칹�壬���к���1��ȩ����2���ǻ��ķ����廯���ﹲ��______�֡�
�ж���ͬ���칹�壬���к���1��ȩ����2���ǻ��ķ����廯���ﹲ��______�֡�
(6)��������A���������ʺϳ� ������ͼ��A
������ͼ��A![]() ����
����![]()

![]()
 �������ҷ�Ӧ�Ļ�ѧ����ʽΪ________��
�������ҷ�Ӧ�Ļ�ѧ����ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ϊ2 L���ܱ������У�����2mol CO2 ��2mol H2���������»�ѧ��Ӧ��CO2��g����H2��g��![]() CO��g����H2O��g��,�仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO��g����H2O��g��,�仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
(1)�÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK �� _____________��
(2)�÷�ӦΪ____________��Ӧ��ѡ������������������������
(3)���жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������______________��
a��������ѹǿ���� b����������� c��CO������
c��������H2����������H2O�� d��c��CO2����c��CO��
(4)ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2����c��H2����c��CO����c��H2O�������жϴ�ʱ���¶�Ϊ________�档
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ������ͬϵ����ǣ� ��
��![]() ��
��![]() ��
��![]() ��C2H4 ��CH2=CH-CH=CH2 ��C3H6 ��
��C2H4 ��CH2=CH-CH=CH2 ��C3H6 ��![]() ��
��![]()
A.�ܺ͢�B.�١��ں͢�C.�ݡ��ߺ͢�D.�͢�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com