
【题目】下列物质一定属于同系物的是( )
①![]() ②
②![]() ③
③![]() ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦![]() ⑧
⑧![]()
A.④和⑧B.①、②和③C.⑤、⑦和⑧D.⑥和⑧
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时,加入一定量的NO、O2,发生如下反应:2NO(g)+O2(g) ![]() 2NO2(g) ΔH< 0,反应过程中n(NO)随时间的变化如下表:
2NO2(g) ΔH< 0,反应过程中n(NO)随时间的变化如下表:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 |
n(NO)/mol | 0. 20 | 0. 10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)计算该反应在20秒内用O2表示的反应速率v(O2)= ______________ ;
(2)写出该反应的平衡常数表达式____________。升高温度该反应平衡常数会_______(填“增大”“减小”或“不变”)
(3)下列示意图正确且能说明反应达到平衡状态的是___________

(4)能使该反应的反应速率增大,且NO的平衡转化率也增大的是__________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(5)已知:2NO(g)![]() N2(g)+O2(g) K1=1×1030;2CO2(g)
N2(g)+O2(g) K1=1×1030;2CO2(g)![]() 2CO(g)+O2(g)K2= 4×10-92。随着轿车进入家庭,汽车尾气(含碳氢化合物、一氧化碳、二氧化硫、一氧化氮等物质)污染成为备受关注的环境问题,某市政府要求全市新有汽车尾气处理装置完成改装,改装后的尾气处理装置主要是加了有效催化剂。请你根据以上有关数据回答:
2CO(g)+O2(g)K2= 4×10-92。随着轿车进入家庭,汽车尾气(含碳氢化合物、一氧化碳、二氧化硫、一氧化氮等物质)污染成为备受关注的环境问题,某市政府要求全市新有汽车尾气处理装置完成改装,改装后的尾气处理装置主要是加了有效催化剂。请你根据以上有关数据回答:
①2NO(g)+2CO(g) ![]() N2(g)+ 2CO2(g) K=_____________
N2(g)+ 2CO2(g) K=_____________
②仅使用催化剂_______(填“能”或“否”)消除NO、CO污染气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)=2G(g)忽略固体体积,平衡时G的体积分数![]() 随温度和压强的变化如表所示:
随温度和压强的变化如表所示:
| 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | b |
915 | c | 75.0 | d |
1000 | e | f | 83.0 |
①b>f ②915℃,2.0MPa时E的转化率为60% ③该反应的S>0 ④K(1000℃)>K(810℃)。上述中正确的有
A.4个B.3个C.2个D.1个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g)+yB(?) ![]() zC(g);平衡时测得A的浓度为0.45 mol/L,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得A的浓度增大为0.9 mol/L。下列有关判断正确的是
zC(g);平衡时测得A的浓度为0.45 mol/L,保持温度不变,将容器的容积压缩到原来的一半,再达平衡时,测得A的浓度增大为0.9 mol/L。下列有关判断正确的是
A. 各物质的计量数一定满足:x+y=z
B. 若B为气体,压缩后B的体积分数增大,转化率降低
C. 无论B为固体或气体,压缩后B的质量都不会改变
D. 压缩时,平衡向逆反应方向移动,且正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末![]() 含
含![]() 、
、![]() 、
、![]() 、FeO等物质
、FeO等物质![]() 某课题小组以此粉末为原料,设计如图1工艺流程对资源进行回收,得到
某课题小组以此粉末为原料,设计如图1工艺流程对资源进行回收,得到![]() 和硫酸铁铵矾:
和硫酸铁铵矾:

已知:
Ⅰ![]() 酸性条件下,铈在水溶液中有
酸性条件下,铈在水溶液中有![]() 、
、![]() 两种主要存在形式,
两种主要存在形式,![]() 易水解,
易水解,![]() 有较强氧化性;
有较强氧化性;
Ⅱ![]() 不溶于稀硫酸;
不溶于稀硫酸;
Ⅲ![]() 硫酸铁铵矾
硫酸铁铵矾![]() 广泛用于水的净化处理.
广泛用于水的净化处理.
![]() 滤液A的主要成分______
滤液A的主要成分______![]() 填写化学式
填写化学式![]() .
.
![]() 写出反应
写出反应![]() 的离子方程式______.
的离子方程式______.
![]() 反应
反应![]() 之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是______
之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是______
![]() 稀土元素的提纯,还可采用萃取法.已知化合物HT作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为
稀土元素的提纯,还可采用萃取法.已知化合物HT作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为![]() 水层
水层![]() 有机层
有机层![]() 有机层
有机层![]() 水层
水层![]() ,分液得到
,分液得到![]() 有机层
有机层![]() ,再加入
,再加入![]() 获得较纯的含
获得较纯的含![]() 的水溶液.可选择硫酸作反萃取剂的原因是______.
的水溶液.可选择硫酸作反萃取剂的原因是______.
![]() 用滴定法测定制得的
用滴定法测定制得的![]() 产品纯度.
产品纯度.

所用![]() 溶液在空气中露置一段时间后再进行滴定,则测得该
溶液在空气中露置一段时间后再进行滴定,则测得该![]() 产品的质量分数______
产品的质量分数______![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]()
![]() 已知
已知![]() 沉淀的pH范围:
沉淀的pH范围:![]() ,
,![]() 沉淀的pH范围:
沉淀的pH范围:![]() ,
,![]() 沉淀的pH范围:
沉淀的pH范围:![]() ,
,![]() 时
时![]() 能溶于NaOH溶液生成
能溶于NaOH溶液生成![]() 现用
现用![]() 溶液
溶液![]() 含有
含有![]() 杂质
杂质![]() 来制备硫酸铁铵矾.实验中可选用的试剂:
来制备硫酸铁铵矾.实验中可选用的试剂:![]() 溶液、
溶液、![]() 、NaOH溶液、饱和石灰水、稀
、NaOH溶液、饱和石灰水、稀![]() 溶液、稀盐酸.
溶液、稀盐酸.
实验步骤依次为:
![]() 向含有
向含有![]() 杂质的
杂质的![]() 溶液中,加入足量的NaOH溶液至
溶液中,加入足量的NaOH溶液至![]() ,______;
,______;
![]() ______;
______;
![]() 向
向![]() 中得到的溶液中加入硫酸铵溶液,______、______过滤、洗涤、常温晾干,得硫酸铁铵晶体
中得到的溶液中加入硫酸铵溶液,______、______过滤、洗涤、常温晾干,得硫酸铁铵晶体![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于mA(s)+nB(g)eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
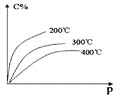
A.化学方程式中n<e+f
B.达到平衡后,若升温,平衡逆向移动
C.达到平衡后,加入催化剂,则C%增大
D.达到平衡后,增加A的量,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有无水乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH。
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
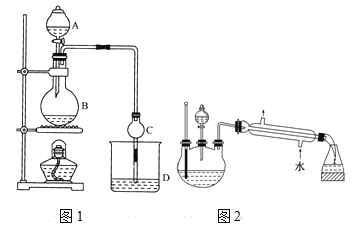
请回答:
(1)浓硫酸的作用是____;用同位素18O示踪法确定反应产物水分子中氧原子的提供者,若用18O标记乙醇分子中的氧原子,请写出该化学方程式:________。
(2)球形干燥管C的作用是_______。若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是_______。
(3)采用分液法从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入无水氯化钙,分离出________;再加入无水硫酸钠除去水,然后进行________(填操作名称),以得较纯净的乙酸乙酯。
(4)上述实验中饱和碳酸钠溶液的作用是______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(5)另一化学课外小组对上述实验进行了改进,设计了图2所示的装置,利用浓硫酸、乙醇、乙酸制取乙酸乙酯(铁架台、铁夹、加热装置均已略去)与图1所示装置相比,此装置的主要优点有(写出一条即可)________。
(6)该实验中用30g乙酸与46g乙醇反应,如果实际得到的乙酸乙酯的质量是26.4g,则该实验中乙酸乙酯的产率是______。(产率指的是某种生成物的实际产量与理论产量的比值。已知乙醇、乙酸、乙酸乙酯的相对分子质量分别为:46、60、88)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示中正确的是
A.电子式:Na:![]() :Na
:Na
B.中子数为22的钙原子:4222Ca
C.NaHSO3水解的离子方程式:HSO3-+H2O![]() H2SO3+OH-
H2SO3+OH-
D.H2CO3的电离方程式:H2CO3=H++HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓度的氨水中存在下列平衡:NH3·H2O![]()
![]() +OH-,如想减小
+OH-,如想减小![]() 的浓度,而增大OH-的浓度,采取措施有效的是( )
的浓度,而增大OH-的浓度,采取措施有效的是( )
A.通入HClB.加入NH4Cl固体
C.加入少量FeCl3D.加入少量NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com