
【题目】对于mA(s)+nB(g)eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
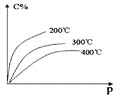
A.化学方程式中n<e+f
B.达到平衡后,若升温,平衡逆向移动
C.达到平衡后,加入催化剂,则C%增大
D.达到平衡后,增加A的量,平衡正向移动
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则表示CH4燃烧热的热化学方程式是_______________________。
(2)已知:C(s) + O2(g)![]() CO2(g) ΔH1 =-437.3 kJmol-1
CO2(g) ΔH1 =-437.3 kJmol-1
2H2(g) + O2(g) ![]() 2H2O(g) ΔH2 =-571.6 kJmol-1
2H2O(g) ΔH2 =-571.6 kJmol-1
2CO(g) +O2(g)![]() 2CO2(g) ΔH3 =-566.0 kJmol-1
2CO2(g) ΔH3 =-566.0 kJmol-1
则煤气化主要反应的热化学方程式是:C(s)+ H2O(g)![]() CO(g) + H2(g) ΔH =________kJmol-1。如果该反应ΔS =+133.7 J·mol-1·K-1 ,该反应在常温下 _______自发进行(填 “能”或“不能”)。
CO(g) + H2(g) ΔH =________kJmol-1。如果该反应ΔS =+133.7 J·mol-1·K-1 ,该反应在常温下 _______自发进行(填 “能”或“不能”)。
(3) 已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则反应N2(g)+3H2(g) ![]() 2NH3 (g) ΔH =_________
2NH3 (g) ΔH =_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值。下列说法正确的是( )
A.将0.2 molFeCl3 水解制成胶体,所得胶体粒子数为0.2 NA
B.25℃时,1LpH=13的Ba(OH)2溶液中含有OH-离子数为0.2 NA
C.0.1mol·L1 NH4Cl溶液中 NH![]() 数小于0.1 NA
数小于0.1 NA
D.1L 2mol·L1K2S溶液中H2S、S2-和HS-的总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体缺乏维生素A,会出现皮肤干燥、夜盲症等症状。维生素A又称视黄醇,分子结构如图所示,下列说法正确的是( )
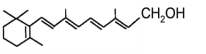
A.维生素A是一种易溶于水的醇
B.维生素A能被氧化得到酮
C.1mol维生素A最多能与5molH2发生加成反应
D.维生素A的分子式为C20H32O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质一定属于同系物的是( )
①![]() ②
②![]() ③
③![]() ④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦
④C2H4 ⑤CH2=CH-CH=CH2 ⑥C3H6 ⑦![]() ⑧
⑧![]()
A.④和⑧B.①、②和③C.⑤、⑦和⑧D.⑥和⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和食盐水来制取烧碱,所用的食盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.用盐酸调节滤液的pH,获得一次精制盐水。
(1)过程Ⅰ中除去的离子是______。
(2)表是过程Ⅰ、Ⅱ中生成的部分沉淀及其在20℃时的溶解度(g/100 gH2O):
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
运用表中信息回答下列问题:
①过程Ⅱ中生成的主要沉淀除CaCO3和Mg2(OH)2CO3外还有______。
②过程Ⅰ选用的是BaCl2而不选用CaCl2,原因是______。
③除去Mg2+的离子方程式是______。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是______。
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意图如图:
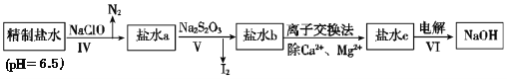
①过程Ⅳ除去的离子是______。
②盐水b中含有SO42-,Na2S2O3将IO3-还原为I2的离子方程式是______。
③在过程Ⅴ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O为了测定其含Na2S2O3·5H2O的纯度,称取8.00 g样品,配制成250.0 mL溶液,取25.00 mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500 mol/L的碘水滴定(发生反应2S2O32-+I2=S4O62-+2I-),滴定达到终点时的现象是______。下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
第一次 | 0.30 | 31.12 |
第二次 | 0.36 | 31.56 |
第三次 | 1.10 | 31.88 |
计算样品的纯度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
B.1mol NaHSO4熔融态时含有2NA个离子
C.含32g硫原子的CS2分子中含有的σ键数目为2NA
D.常温常压下,10 g D2O含有的质子数、电子数、中子数均为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
选项 | 实验 | 现象 | 结论 |
A | 向添有KIO3的食盐中加入淀粉溶液、稀盐酸及KI | 溶液变蓝色 | 氧化性:IO3- >I2 |
B | 将SO2气体通入到Ba(NO3)2溶液中 | 生成白色沉淀 | 此沉淀是BaSO3 |
C | 将FeCl2样品溶于盐酸后,滴加KSCN溶液 | 溶液变成红色 | 原FeCl2样品已变质 |
D | 燃烧的钠粒放入CO2中 | 燃烧且有白色和黑色颗粒产生 | 黑色颗粒是炭,白色颗粒可能是Na2CO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H-H键的键能为436kJ· mol-1,H-N键的键能为391 kJ· mol-1,根据热化学方程式:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4 kJ· mol-1,可知N≡N键的键能是
2NH3(g) △H=-92.4 kJ· mol-1,可知N≡N键的键能是
A.431 kJ· mol-1B.649 kJ· mol-1C.945.6 kJ· mol-1D.896 kJ· mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com