
【题目】标准状况下,向100 mLNaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的PH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
已知图中B点位置固定,且V(B)=300,而点A C 可在各自的轴上移动。
(1)原溶液的物质的量浓度为_________mol/L,B点时,最终所得溶液中的溶质的物质的量浓度是___________mol/L(两种溶液混合时体积可以直接相加)
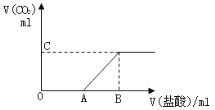
(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
V(A)的取值 | V(A)=0 | 0<V(A)<150 | V(A)=150 | 150<V(A)<300 |
溶质的成分 | ①__________ | ②___________ | ③_________ | ④_____________ |
当V(A)=200时,C点数值为_____________。
(3)取V(A)=100时对应的溶液M 30ml 与等体积的1 mol/L的盐酸按各种可能的方式混合,产生的气体体积Vml,则V 的取值范围是___________________。
【答案】3 0.75 NaHCO3 Na2CO3和NaHCO3 Na2CO3 NaOH和Na2CO3 2240 0≤V≤448
【解析】
向100 mLNaOH溶液中缓慢通入一定量的CO2气体,发生反应:
2NaOH+CO2=Na2CO3+H2O,Na2CO3+CO2+H2O==2NaHCO3
在生成的M溶液中滴加盐酸,发生如下反应:
OA段,NaOH+HCl=NaCl+H2O,Na2CO3+HCl=NaCl+ NaHCO3
AB段,NaHCO3+HCl=NaCl+H2O+CO2↑,据此分析作答
(1)从B点切入,因为此时产物为NaCl,所以n(NaCl)=n(NaOH)=1mol/L×0.3L=0.3mol。
原溶液的物质的量浓度为![]() mol/L。答案为:3;
mol/L。答案为:3;
B点时,最终所得溶液中的溶质的物质的量浓度是![]() mol/L。
mol/L。
答案为:0.75;
(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
V(A)的取值 | V(A)=0 | 0<V(A)<150 | V(A)=150 | 150<V(A)<300 |
溶质的成分 | ①__________ | ②___________ | ③_________ | ④_____________ |
从表中可以看出,V(A)=0时,①溶质为NaHCO3。答案为:①NaHCO3
当0<V(A)<150时,②溶质为Na2CO3和NaHCO3。答案为:②Na2CO3和NaHCO3
当V(A)=150时,③溶质为Na2CO3。答案为:③Na2CO3
当150<V(A)<300,④溶质为NaOH和Na2CO3。答案为:④NaOH和Na2CO3
当V(A)=200时,C点溶质为NaOH和Na2CO3,且二者的物质的量之比为1:1。
则AB段发生的反应为:NaHCO3+HCl=NaCl+H2O+CO2↑
0.1L×1mol/L 0.1mol
V(CO2)=0.1mol×22.4L/mol=2.24L=2240mL
答案为:2240;
(3)由上面分析知,V(A)=100时对应的溶液M中,溶质为Na2CO3和NaHCO3,二者的物质的量之比为1:1,且二者的浓度都是1mol/L。
若将盐酸加入M溶液中,n(Na2CO3)= 1mol/L×0.03L=0.03mol,
n(NaHCO3)= 1mol/L×0.03L=0.03mol,n(HCl)= 1mol/L×0.03L=0.03mol。
发生反应为Na2CO3+HCl=NaCl+ NaHCO3
0.03mol 0.03mol
盐酸将Na2CO3转化为NaHCO3便消耗完,所以生成二氧化碳的体积为0。
若将M溶液滴入盐酸中,发生反应为:
Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑
0.01mol 0.02mol 0.01mol 0.01mol 0.01mol 0.01mol
共生成CO2气体的体积为:0.02mol×22400mL/mol=448mL
故取V(A)=100时对应的溶液M 30mL与等体积的1 mol/L的盐酸按各种可能的方式混合,产生的气体体积VmL,则V 的取值范围是0≤V≤448
答案为:0≤V≤448;


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示。下列说法一定正确的是( )
A. 最高正化合价:Z>X
B. X、Y、Z的单质中,Z的熔点最高
C. 若X为非金属元素,则离子半径:Xn->Ym->Zm-
D. 若X为金属元素,则X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”是一种以NaClO为主的高效消毒剂,被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒。某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:


(1)此“84消毒液”的物质的量浓度约为________。(计算结果保留一位小数)
(2)某同学量取100mL此“84消毒液”,按说明要求稀释后用于消毒,则稀释后的溶液中c(Na+)=___mol/L。
(3)该同学参阅读该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为24%的消毒液。
①如图所示的仪器中配制溶液需要使用的是________________(填仪器序号),还缺少的玻璃仪器是______________。
②该同学配制此溶液需称取称量NaClO固体的质量为_________________g。
(4)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是____________(填序号)。
a.定容时俯视刻度线 b.转移前,容量瓶内有蒸馏水
c.未冷至室温就转移定容 d.定容时水多加了,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能用平衡移动原理解释的是 ( )
A. 升高温度水的离子积增大
B. 镁条与氯化铵溶液反应生成氢气
C. 碳酸钙与稀盐酸反应生成二氧化碳
D. 加入少量硫酸铜可增大锌与稀硫酸反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为1L的密闭容器中,0.3molX和0.2molY进行反应:2X(g)+Y(s) ![]() Z(g),经10s达到平衡,生成0.1molZ。下列说法正确的是( )
Z(g),经10s达到平衡,生成0.1molZ。下列说法正确的是( )
A. 若增加Y的物质的量,则V正大于V逆平衡正向移动
B. 以Y浓度变化表示的反应速率为0.01mol·L-1·s-1
C. 该反应的平衡常数为10
D. 若降低温度,X的体积分数增大,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O IO![]() →I2 MnO
→I2 MnO![]() →Mn2+ HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
→Mn2+ HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A. H2O2 B. HNO2 C. MnO![]() D. IO
D. IO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标况下),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合气体,且体积比为1:1,则V可能为( )
A.8.4LB.13.5LC.10.7LD.16.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组在探究新制饱和氯水成分的实验中,根据实验现象推测的有关结论中错误的是
A.向氯水中滴入紫色石蕊溶液看到其先变红后褪色,推测氯水中含有Cl2分子
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,推测氯水中可能含有Cl-
C.向氯水中加入碳酸钠粉末,有气泡产生,推测氯水中含有H+
D.氯水放置一周后pH将变大,说明氯水中含有ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224L氯化氢气体完全溶于635mL的水(密度为1g/cm3)中,所得盐酸的密度为1.18g/cm3,该溶液中溶质的物质的量是多少__?该盐酸中溶质的质量分数是多少__?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com