
【题目】下列实验事实不能用平衡移动原理解释的是 ( )
A. 升高温度水的离子积增大
B. 镁条与氯化铵溶液反应生成氢气
C. 碳酸钙与稀盐酸反应生成二氧化碳
D. 加入少量硫酸铜可增大锌与稀硫酸反应的速率
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案科目:高中化学 来源: 题型:
【题目】赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S![]() 6Cu+SO2↑,对于该反应,下列说法正确的是
6Cu+SO2↑,对于该反应,下列说法正确的是
A. 该反应的氧化剂只有Cu2O B. Cu既是氧化产物,又是还原产物
C. Cu2S既是氧化剂又是还原剂 D. 还原产物与氧化产物的物质的量之比为1∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):

已知:
回答下列问题:
(1)B的结构简式为____________,C中含有的官能团名称是______________。
(2)若D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子, D中氧元素的质量分数约为13.1%,则D的结构简式为______________,⑥的反应类型是________________。
(3)写出苯乙醛与新制的银氨溶液反应的离子方程式:___________________。
(4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:________________。
i .含有苯环和 ![]() 结构
结构
ii.核磁共振氢谱有4组峰,且峰面积之比为3 : 2 : 2 : 1
(5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3溶液显色的E的所有同分异构体共有(不考虑立体异构)__________种。
(6)参照 的合成路线,写出由2-氯丙烷和必要的无机试剂制
的合成路线,写出由2-氯丙烷和必要的无机试剂制 的合成流程图:___________________。合成流程图示例如下:CH2=CH2
的合成流程图:___________________。合成流程图示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题:
(1)O原子中价电子占据的轨道数目为______________。
(2)第一电离能I1:N__________O(填“>”或“<”),第二电离能I2:O大于N的原因是_________________。
(3)O3的空间构型为__________________;分子中存在大π键,可用符号Π![]() 表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为___________________________________。
表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为___________________________________。
(4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H—N、____________________、__________________________(任写两种即可)。
(5)已知:表格中键能和键长数目。
化学键 | 键长/pm | 键能/(kJ·mol-1) |
N-N | 145 | 193 |
N=N | 125 | 418 |
N≡N | 110 | 946 |
N2和N4都是N元素的单质,其中N4是正四面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是________________________。
(6)Na2O的晶胞结构如图所示 ,X表示O2-,Y表示Na+,则O2-的配位数为____________,该晶胞的原子空间利用率为_____________。[已知该晶胞的棱长为a pm,r(Na+)=x pm,r(O2-)=y pm]
,X表示O2-,Y表示Na+,则O2-的配位数为____________,该晶胞的原子空间利用率为_____________。[已知该晶胞的棱长为a pm,r(Na+)=x pm,r(O2-)=y pm]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有少量Na2O2的试管中加入蒸馏水,得到溶液a | 反应剧烈,产生能使带火星木条复燃的气体 |
然后向溶液a中滴入两滴酚酞 | 溶液先变红,再逐渐变浅,约10分钟溶液变为无色 |
为了探究溶液变为无色的原因,该同学按照科学的程序,进行了如下实验:
(推理与假设)
Na2O2与H2O反应的化学方程式_____。向溶液a中滴加酚酞本应只会变红,而实验中发现酚酞变红后又褪色。由此提出如下的假设:
假设A:O2有漂白性 假设B:NaOH有漂白性 假设C:O2和NaOH共同作用有漂白性
(实验与观察)
(2)请完成下表:
实验编号 | 1 | 2 | 3 |
实验装置 |
|
|
|
实验假设 (填“A”、“B”或“C”) | 假设_____ | 假设____ | 假设__ |
实验现象 | 溶液变红后10分钟均无变化 | ||
实验结论 | _____ | ||
(查阅资料)
该同学查阅资料:H2O2是一种在碱性条件下不稳定、具有漂白性的物质。
(推理与假设)
该同学认为褪色的原因可能是溶液a中存在H2O2,H2O2漂白了酚酞。
(实验与观察)
(3)通过实验证实了H2O2的存在:取少量溶液a,加入黑色粉末____(填化学式),快速产生了能使带火星木条复燃的气体。该同学进一步通过实验证实了溶液a中滴入酚酞后,H2O2与酚酞发生了化学反应。实验方案:取少量溶液a于试管中,_____。
(解释与结论)
(4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B.海带灰浸泡滤液中加入稀硫酸后再加入双氧水:2I-+ H2O2+4H+ = I2+2H2O
C.用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++4Cl-![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D.1L4mol·L-1 NaOH溶液中通入67.2LCO2(标准状况下),反应的离子方程式为:4OH- +3CO2 = 2HCO3-+CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,向100 mLNaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的PH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
已知图中B点位置固定,且V(B)=300,而点A C 可在各自的轴上移动。
(1)原溶液的物质的量浓度为_________mol/L,B点时,最终所得溶液中的溶质的物质的量浓度是___________mol/L(两种溶液混合时体积可以直接相加)
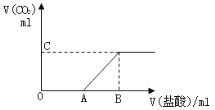
(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
V(A)的取值 | V(A)=0 | 0<V(A)<150 | V(A)=150 | 150<V(A)<300 |
溶质的成分 | ①__________ | ②___________ | ③_________ | ④_____________ |
当V(A)=200时,C点数值为_____________。
(3)取V(A)=100时对应的溶液M 30ml 与等体积的1 mol/L的盐酸按各种可能的方式混合,产生的气体体积Vml,则V 的取值范围是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用98%的浓硫酸(其密度为1.84g/cm3)配制240mL1.0mol/L稀硫酸,若实验仪器有:量筒、烧杯、玻璃棒
(1)需量取浓硫酸的体积为___mL;
(2)实验时还需要的仪器有___;
(3)配制过程中,下列情况会使配制结果偏高的是___(填序号)
①容量瓶使用时未干燥
②定容后经振荡,摇匀,静置,发现液面低于刻度线,再加蒸馏水补至刻度线
③移液后未洗涤烧杯和玻璃棒
④定容时仰视刻度线观察液面
⑤量取浓H2SO4后,用蒸馏水洗涤量筒内壁,并将洗涤液注入烧杯中,一并移液
Ⅱ.请计算28gKOH固体必须溶解在___g水中,才使200个水分子中有1个K+;所得溶液的密度为![]() g/cm3,则该溶液中OH-的物质的量浓度为___(保留到小数点后两位)。
g/cm3,则该溶液中OH-的物质的量浓度为___(保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确
①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al![]() Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C![]() SiC(硅为+4价)+2CO↑;1∶2
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O===2HNO3+NO;2∶1
A. ①③ B. ②③ C. ②④ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com